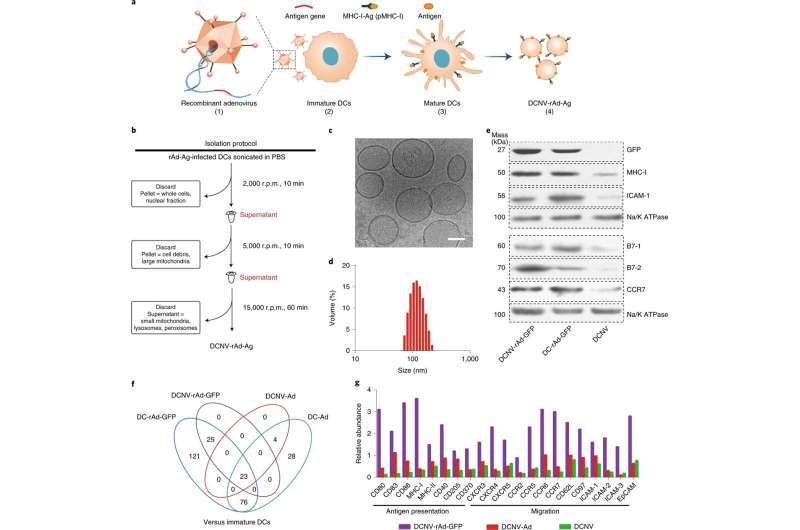
Generatie en karakterisering van DCNV-rAd-Ag. a, Generatie van DCNV’s afgeleid van met adenovirus geïnfecteerde rijpe dendritische cellen. (1) De genen van tumorspecifiek antigeen werden genetisch gemanipuleerd in de adenovirusvector. (2) Recombinant adenovirus infecteerde de onrijpe DC2.4-cellen om het gemodificeerde antigeen op het celoppervlak tot expressie te brengen en het te stimuleren. (3) Differentiatie, rijping en antigeenpresentatie. (4) Oogsten van het geïnduceerde rijpe celmembraan en bereiding van DCNV-rAd-Ag. b, Schematische illustratie van de generatie van DCNV-rAd-Ag. c, d, Cryo-elektronenmicroscopie (c) en dynamische lichtverstrooiingsanalyses (d) toonden uniforme DCNV-rAd-Ag (ongeveer 108 nm gemiddelde diameter, polydispersiteitsindex = 0,14) met een blaasjesachtige morfologie. Schaalbalk, 50 nm. e, De western blot op membraaneiwitten van DCNV-rAd-GFP toont een vergelijkbaar eiwitgehalte aan het oppervlak in vergelijking met dat van de oudercellen. Panelen c-e tonen representatieve resultaten van twee onafhankelijke experimenten met vergelijkbare resultaten. f, Vergelijking van opgereguleerde immuunrespons-gerelateerde eiwitten in NV’s en DC’s. g, De relatieve overvloed aan antigeenpresentatie en migratiegerelateerde eiwitten op DCNV-rAd-GFP. rpm, omwentelingen per minuut. CCR, CC-chemokinereceptor; CXCR, CXC-chemokinereceptor; EpCAM, epitheliaal cellulair adhesiemolecuul; ICAM 1, intercellulair adhesiemolecuul 1; pMHC-I, peptide-groot histocompatibiliteitscomplex klasse I. Krediet: Natuur Nanotechnologie (2022). DOI: 10.1038/s41565-022-01098-0
Terwijl mensen over de hele wereld uitkijken naar een langere levensverwachting, blijven kwaadaardige kankers een bedreiging vormen voor de menselijke gezondheid. De exploratie en ontwikkeling van immunotherapie is gericht op het zoeken naar nieuwe doorbraken voor de behandeling van solide tumoren.
De succesvolle vestiging van antitumorimmuniteit vereist de activering, uitbreiding en differentiatie van antigeenspecifieke lymfocyten. Dit proces hangt grotendeels af van specifieke interacties tussen verschillende T-cellen en antigeenpresenterende cellen (APC’s) in het lichaam. Bestaande tumorvaccins, zoals neoantigeenvaccins en verschillende vectorvaccins, zijn echter allemaal afhankelijk van willekeurige interacties met APC’s in het lichaam. Bovendien kunnen ongepaste interacties leiden tot het tot zwijgen brengen van andere immuunreacties.
Hoewel is aangetoond dat immunotherapie op basis van immuuncheckpoints een groot potentieel heeft, reageert slechts een klein deel van de patiënten volledig op deze therapie en moeten de relevante moleculaire mechanismen verder worden onderzocht. Deze leveringsmethode is echter complex en inefficiënt.
In een baanbrekende ontwikkeling heeft een team van wetenschappers onder leiding van Narat Muzayyin-voorzitter professor Chen Xiaoyuan van de NUS Yong Loo Lin School of Medicine en professor Liu Gang van de Universiteit van Xiamen een nieuw vaccin geformuleerd dat een hoge werkzaamheid vertoonde bij de behandeling van solide tumoren. volledige klaring van solide tumoren en het induceren van langdurig immuungeheugen. Dit voorkomt terugval van de tumorgroei die de patiënt oorspronkelijk had en biedt immuniteit tegen vergelijkbare tumortypen. Dit werd bewezen door toepassing van dit vaccin op melanoomtumormodellen. Hun resultaten zijn gepubliceerd in Natuur Nanotechnologie.
Het team was in staat om een dendritische celmembraan (een type APC) te ontwikkelen dat werd gebruikt om het immuunsysteem op natuurlijke wijze te stimuleren en multidimensionale antitumorimmuniteit te activeren. Dit werd gedaan door middel van een antigeen-zelfpresentatie en immunosuppressie-reversal nanovesicle-vaccinplatform, wat het team ertoe bracht zijn bijnaam ASPIRE te gebruiken.
Het ASPIRE-vaccinsysteem kan snel geschikte, antigeenspecifieke immuunresponsen opwekken op een manier die traditionele vaccinmethoden niet zouden kunnen. Deze wijze van antigeenpresentatie verbetert de efficiëntie van immuunactivatie aanzienlijk, wat de hoge werkzaamheid van dit nieuwe vaccin in vergelijking met andere momenteel beschikbare vaccins mogelijk maakt. Bovendien kan het vaccin zowel eerder niet-blootgestelde T-cellen als uitgeputte T-cellen activeren, wat de superieure anti-tumor immuuncapaciteiten van ASPIRE bevordert.
“We zijn enthousiast over het potentieel van deze platformtechnologie voor verdere toepassing bij andere ziekten, zoals chronische virale infectie, waarbij T-celuitputting vaak optreedt tijdens infectie en de optimale virale controle verhindert”, zei prof. Chen. “Vervolgens hoopt het team een standaardwerkprocedure vast te stellen voor geschaalde synthese van het vaccin, met een goede kwaliteitscontrole van de membraanblaasjes, voor klinische vertaling,” voegde hij eraan toe.
Professor Chng Wee Joo, senior adviseur van de afdeling Hematologie van de afdeling Hematologie-Oncologie van het National University Cancer Institute, Singapore en myeloomspecialist, sprak onafhankelijk over de studie en zei: “Het gebied van kankerimmunotherapie biedt enorme hoop voor kanker patiënten. Er zijn echter enkele tekortkomingen met de huidige technologieën. De huidige innovatie van Prof Chen en zijn collega’s heeft een aantal van deze tekortkomingen verholpen en de effectiviteit en
duurzaamheid van de immuunrespons op deze behandelingen. Dit zal een aanzienlijke vooruitgang opleveren die een belangrijke impact zal hebben op patiënten.”
Chao Liu et al, Een nanovaccin voor zelfpresentatie van antigeen en omkering van immunosuppressie als een gepersonaliseerde strategie voor kankerimmunotherapie, Natuur Nanotechnologie (2022). DOI: 10.1038/s41565-022-01098-0
Natuur Nanotechnologie
Geleverd door de Nationale Universiteit van Singapore