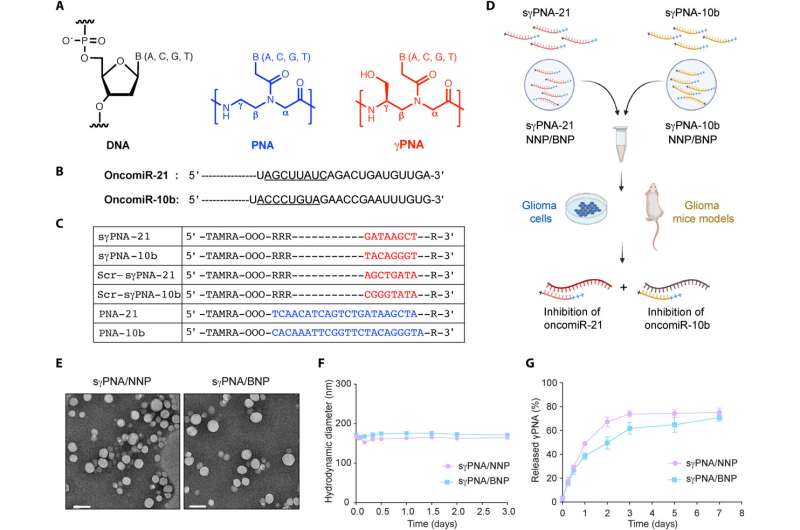
Ontwerp van PNA’s en karakterisering van NP’s. (A) Chemische structuur van DNA, PNA en serine-γ-PNA. (B) De volgorde van oncomiR-21 en oncomiR-10b, waarbij het onderstreepte segment het zaadgebied is. (C) PNA’s gebruikt in het onderzoek. sγPNA-21 en sγPNA-10b zijn serine-γPNA’s die zijn ontworpen om te binden aan het zaadgebied van respectievelijk oncomiR-21 en oncomiR-10b. Drie arginine (RRR) residuen zijn toegevoegd aan het N-uiteinde en één arginine (R) aan het C-uiteinde. Scr-sγPNA-21 en Scr-sγPNA-10b zijn gecodeerde versies van respectievelijk sγPNA-21 en sγPNA-10b. PNA-21 en PNA-10b zijn gewone PNA’s die zijn ontworpen om respectievelijk oncomiR-21 en oncomiR-10b over de volledige lengte te binden. PNA’s werden geconjugeerd met TAMRA, een fluorescerende kleurstof voor beeldvorming. OOO vertegenwoordigt 8-amino-2,6,10-trioxaoctaanzuurresiduen (Mini-PEG). (D) Grafische weergave van sγPNA-inkapseling in NP’s (NNP of BNP) en behandelingsstrategie voor de gelijktijdige remming van oncomiR’s 21 en 10b. (E) TEM-afbeeldingen van sγPNA/NNP en sγPNA/BNP. Schaalbalken, 100 nm. (F) Groottestabiliteit van sγPNA/NNP en sγPNA/BNP in aCSF. (G) De hoeveelheid sγPNA (sγPNA-21 en sγPNA-10b) die in de loop van de tijd uit NP’s vrijkwam tijdens incubatie in gebufferde zoutoplossing, werd bepaald en gekwantificeerd als een percentage van de geladen hoeveelheid. De gegevens worden weergegeven als gemiddelden ± SD (n = 3). Credit: Wetenschappelijke vooruitgang (2023). DOI: 10.1126/sciadv.abq7459
Een team van onderzoekers, waaronder leden van de Universiteit van Connecticut, heeft een op nanodeeltjes gebaseerde behandeling ontwikkeld die zich richt op meerdere boosdoeners bij glioblastoom, een bijzonder agressieve en dodelijke vorm van hersenkanker.
De resultaten, een samenwerking tussen UConn en Yale University, zijn vandaag gepubliceerd in Wetenschappelijke vooruitgang.
De nieuwe behandeling maakt gebruik van bioadhesieve nanodeeltjes die zich hechten aan de plaats van de tumor en vervolgens langzaam de gesynthetiseerde peptide-nucleïnezuren vrijgeven die ze dragen. Deze peptide-nucleïnezuren richten zich op bepaalde microRNA’s, dat wil zeggen korte RNA-strengen die een rol spelen bij genexpressie. In het bijzonder zijn ze gericht op een type tot overexpressie gebracht microRNA dat bekend staat als “oncomiR’s” en dat leidt tot de proliferatie van kankercellen en de groei van de tumor. Wanneer de peptide-nucleïnezuren zich hechten aan de oncomiR’s, stoppen ze hun tumorbevorderende activiteit.
De laboratoria van professoren Raman Bahal van de UConn School of Pharmacy en Mark Saltzman van Yale werkten samen aan het behandelingssysteem. In tegenstelling tot vergelijkbare inspanningen, die zich slechts op één oncomiR tegelijk richten, richt deze behandeling zich op twee, waardoor het effect op kankercellen sterker wordt. De proefmuizen die de behandeling kregen, leefden significant langer dan de controlemuizen.
“Het kan beide doelen tegelijkertijd neerhalen, wat een opmerkelijk krachtiger resultaat blijkt te hebben, zoals we zagen met de verhoogde overlevingsresultaten”, zegt Saltzman, een professor in biomedische technologie, chemische en milieutechniek en fysiologie. “Deze resultaten zijn de beste die ik ooit heb gezien bij dit soort agressieve hersentumoren.”
Een uitdaging bij het ontwikkelen van de behandeling was het ontwerpen van de antikankermiddelen, bekend als antimiR’s, zodat twee verschillende in een enkel nanodeeltje konden passen.
“We hebben al deze verbindingen gesynthetiseerd en kwamen op het idee dat je je niet op één oncomiR tegelijk hoeft te richten”, zegt Bahal, universitair hoofddocent farmacie. “Nu kunnen we nadenken over meerdere oncomiR-doelen.”
Voor dit werk richtten de onderzoekers zich op de oncomiR’s die bekend staan als miR-10b en miR-21, die beide veel voorkomen bij glioblastoom. Toekomstige behandelingen kunnen echter gemakkelijk worden aangepast aan specifieke patiënten. Als bijvoorbeeld een biopsie van de tumor van een patiënt een profiel oplevert dat de proliferatie van verschillende oncomiR’s laat zien, kan de behandeling dienovereenkomstig worden gewijzigd.
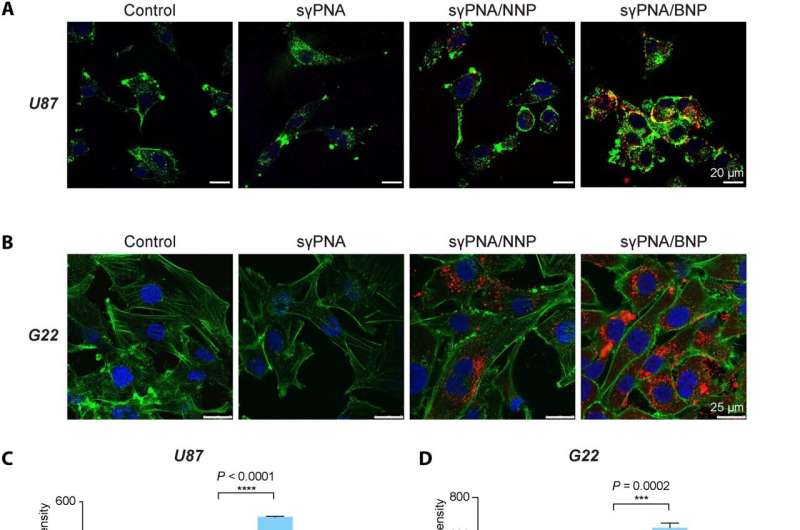
sγPNA-gemedieerde gelijktijdige knockdown van miR-21 en miR-10b in meerdere glioomcellen. (A) Confocaal microscopisch beeld van U87-cellen behandeld met gratis sγPNA of sγPNA-geladen NP’s. Schaalbalken, 20 μm. (B) Confocale microscopische beelden van G22-cellen (patiënt-afgeleide GBM-cellen) behandeld met gratis sγPNA of sγPNA-geladen NP’s. Schaalbalken, 25 μm. PNA’s werden geconjugeerd met TAMRA (rood); F-actine werd gelabeld met phalloidin (groen) en de kern werd gekleurd met Hoechst (blauw). ( C ) Cellulaire opname in U87-cellen geanalyseerd met flowcytometrie. Gegevens worden uitgedrukt als gemiddelden ± SD (n = 3). (D) Kwantificering van cellulaire opname van sγPNA in G22-cellen via flowcytometrie-analyse. Gegevens worden uitgedrukt als gemiddelden ± SD (n = 3). ( E ) Expressieanalyse van miR-10b- en miR-21-niveaus in U87-cellen na behandeling met Scr-sγPNA / NNP, Scr-sγPNA / BNP, sγPNA / NNP, sγPNA / BNP en gratis sγPNA. (F) De niveaus van miR-10b en miR-21 in G22-cellen die in vitro zijn behandeld met sγPNA’s (sγPNA-10b + sγPNA-21) en BNP’s die sγPNA’s en scr-sγPNA’s bevatten. sγPNA/BNP’s zijn een fysiek mengsel van sγPNA-21 BNP en sγPNA-10b BNP. sγPNA/NNP’s zijn een fysiek mengsel van sγPNA-21 NNP en sγPNA-10b NNP. NNP geeft PLA-HPG NP aan en BNP geeft PLA-HPG-CHO NP aan. Credit: Wetenschappelijke vooruitgang (2023). DOI: 10.1126/sciadv.abq7459
Saltzman noemt de behandeling ‘een huwelijk van twee technologieën’.
“Een daarvan is de bioadhesieve nanodeeltjestechnologie, die we eerder hadden ontwikkeld, en deze combineren met deze peptide-nucleïnezuurtechnologie die Raman heeft geperfectioneerd”, zegt hij.
Omdat de behandeling gelokaliseerd is op de tumorplaats, merkte Bahal op dat zowel de gesynthetiseerde nucleïnezuren als de nanodeeltjes die ze naar de tumorplaats brengen, niet-toxisch zijn. Ook cruciaal voor het succes van de behandeling is dat de deeltjes en het middel dat vrijkomt ongeveer 40 dagen op de tumorplaats blijven. Conventionele plaatsspecifieke behandelingen hebben de neiging vrij snel weg te spoelen.
“Dit zijn sterk bindende moleculen die tegelijkertijd schaalbaar en effectief zijn”, zegt Bahal. “Het is gericht en blijft daar. Traditionele moleculen hebben veel uitdagingen gehad op het gebied van toxiciteit.”
Idealiter zou het toedieningssysteem worden toegepast als onderdeel van een groter behandelingsregime.
“We hebben het ontworpen als een aanvulling op wat artsen al doen”, zegt Saltzman. “Ze zouden een operatie doen, dan infuseren ze onze nanodeeltjes, en dan geven ze chemotherapie en / of bestraling zoals ze normaal doen. We verwachten dat dit tot een beter resultaat zou leiden omdat het nanodeeltje / anti-microRNA is het sensibiliseren van de cellen voor de chemotherapie en de bestralingstherapie.”
Andere auteurs van de studie zijn Shipra Malik, een voormalige afgestudeerde student in het laboratorium van Bahal; en Vijender Singh, Associate Director van Computational Biology Core bij UConn.
“Deze studie opent nieuwe wegen voor RNA-gerichte technologie bij het ontwikkelen van gepersonaliseerde therapie voor hersenkanker”, zegt Malik.
Meer informatie:
Yazhe Wang et al, Anti-seed PNA’s gericht op meerdere oncomiR’s voor hersentumortherapie, Wetenschappelijke vooruitgang (2023). DOI: 10.1126/sciadv.abq7459
Tijdschrift informatie:
Wetenschappelijke vooruitgang
Aangeboden door de Universiteit van Connecticut