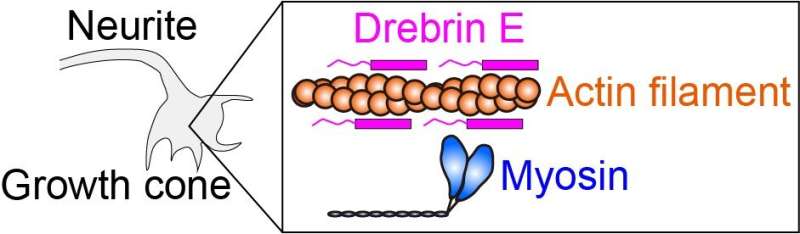
Intracellulaire kracht wordt geproduceerd door myosine in wisselwerking met actinefilament (eiwitfilament). Drebrin E kan de actine-myosine-interactie remmen en zo de intracellulaire kracht reguleren. Het is bekend dat de concentratie van drebrine E tijdens de ontwikkeling van dieren afneemt. Een correlatie tussen de drebrineconcentratie en de actine-myosine-activiteit is echter onduidelijk gebleven, vooral bij de fysiologische temperatuur. Krediet: Hiroaki Kubota et al.
Eén graad Celsius kan het verschil maken: een team van onderzoekers onder leiding van de Universiteit van Osaka heeft de regulatie aangetoond van een kritisch eiwitcomplex dat alleen bij fysiologische temperatuur optreedt.
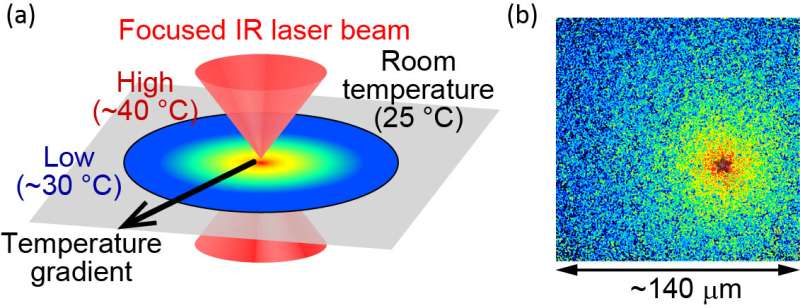
Om de functies van eiwitten te bestuderen, onderzoeken onderzoekers gezuiverde eiwitten in vitro. Dergelijke experimenten zijn over het algemeen beperkt tot temperaturen onder de fysiologische temperatuur om thermische schade aan de eiwitten te voorkomen. Het team heeft dit probleem overwonnen door optisch gestuurde verwarming toe te passen met een gepulste infraroodlaser. “Met deze methode kunnen eiwitten worden verwarmd tot 40 graden Celsius zonder dat de eiwitten beschadigd raken,” zegt hoofdauteur Hiroaki Kubota, “waarmee we kunnen onderzoeken hoe eiwitten werken bij hun fysiologische temperatuur.”
De onderzoekers pasten deze verwarmingsmethode toe om het actomyosinecomplex te bestuderen. Actomyosine-krachtgeneratie, die het gevolg is van de interactie tussen myosine-moleculaire motoren en actinefilamenten, is een cruciaal proces dat de celmotiliteit en morfologie regelt. Het is aangetoond dat het eiwit drebrine E deze interacties remt, maar het regulatiemechanisme ervan is onduidelijk. Om de rol van drebrin E te verduidelijken, paste het team microscopische verwarming toe op actomyosine in de aanwezigheid van drebrin en observeerde de beweeglijkheid geproduceerd door actomyosinekrachtgeneratie over een bereik van kamertemperatuur tot fysiologische temperatuur.
De onderzoekers ontdekten dat de remming van de beweeglijkheid van actomyosine door drebrin E onmiddellijk en omkeerbaar wordt geëlimineerd tijdens verwarming, afhankelijk van de drebrin E-concentratie. Naarmate de temperatuur stijgt, neemt de remming van de beweeglijkheid van actomyosine door drebrine E af. Het team ontdekte ook dat de verminderde remming niet alleen wordt veroorzaakt door dissociatie van drebrin E van actine. In plaats daarvan reguleert gebonden drebrine E samen de actomyosine-activiteit, waarschijnlijk door de actinestructuur te veranderen.
Interessant is dat onder fysiologische temperatuur de beweeglijkheid van actomyosine een geleidelijk verval vertoont met toenemende drebrine E-concentratie. Maar bij 36,5 graden Celsius tot 37,5 graden Celsius verandert het gedrag, en drebrin E vertoont een schakelgedrag van remming. De beweeglijkheid wordt niet beïnvloed door de drebrin E-concentratie totdat een drempel wordt bereikt, wat onmiddellijk resulteert in remming. Hun bevindingen suggereren dat de drempelconcentratie vergelijkbaar is met eerder gerapporteerde fysiologische drebrine E-concentraties.
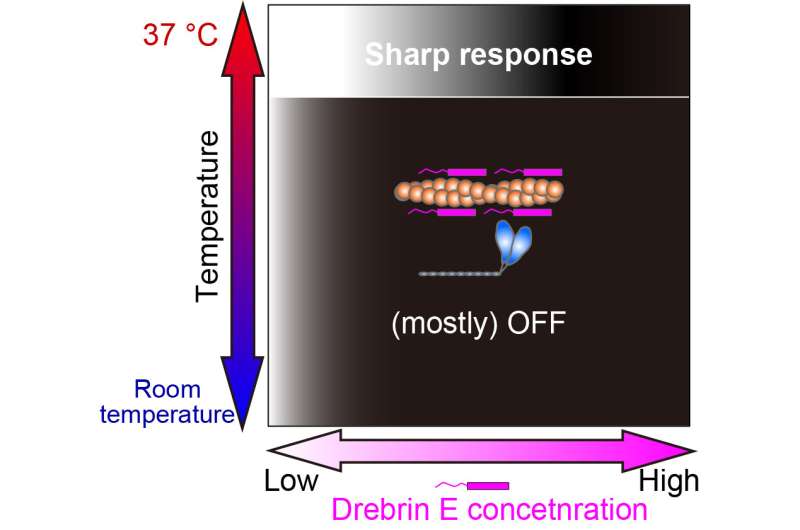
Onze studie onthulde dat de regulatie van actine-myosine-interactie door drebrin E alleen efficiënt is bij de fysiologische temperatuur (37 ° C). De wit-zwart gradatie vertegenwoordigt de krachtproductie Aan (wit) en Uit (zwart). Krediet: Hiroaki Kubota et al.
Deze temperatuurafhankelijke regulatie van drebrin E is opmerkelijk en heeft veel implicaties voor toekomstige studies. “Deze resultaten suggereren het belang voor drachtige zoogdieren om de juiste lichaamstemperatuur te behouden om een nauwkeurige ontwikkeling van een embryo te verzekeren,” zegt Madoka Suzuki, senior auteur. Bovendien kunnen we, door een nauwkeurig begrip te krijgen van de mechanismen van cellulaire temperatuurgevoelige machines, mogelijk de ontwikkeling van kunstmatige temperatuursensoren op nanoschaal innoveren.
Het artikel, “Microscopische temperatuurregeling onthult coöperatieve regulatie van actine-myosine-interactie door drebrin E” werd gepubliceerd in Nano-letters.
“Microscopische temperatuurregeling onthult coöperatieve regulatie van actine-myosine-interactie door drebrin E” Nano-letters (2021). DOI: 10.1021/acs.nanolet.1c02955
Nano-letters
Geleverd door de Universiteit van Osaka