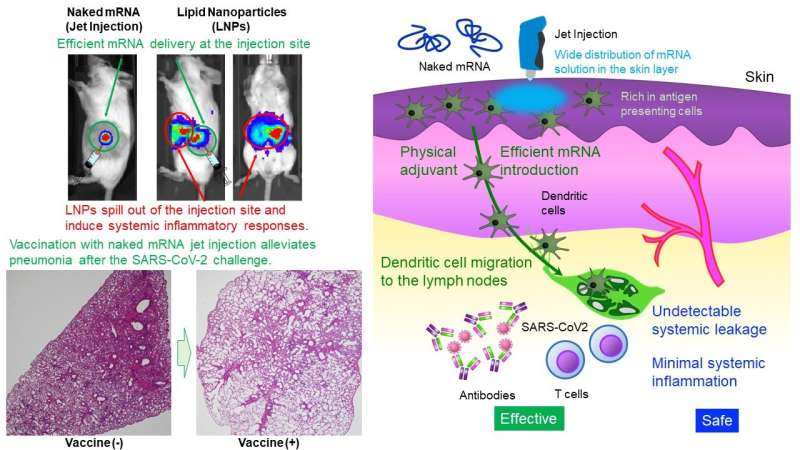
Het Uchida Laboratory of Innovation Center of NanoMedicine heeft aangetoond dat intradermale toediening van alleen mRNA (naakt mRNA) zonder bescherming door nanodeeltjes robuuste vaccinatie tegen SARS CoV-2, een virus dat COVID-19 veroorzaakt, bij muizen en primaten induceerde. mRNA is zeer onstabiel en er wordt algemeen aangenomen dat het voor toediening een kleine capsule, zoals lipide-nanodeeltjes (LNP’s), vereist.
De hier gerapporteerde methode is het eerste naakte mRNA-vaccin dat preventie tegen SARS-CoV-2 aantoont. Zonder het gebruik van LNP’s, die zeer waarschijnlijk systemische bijwerkingen veroorzaken, kan dit vaccin herhaalde dosering mogelijk maken. Het wordt nu ontwikkeld voor klinische onderzoeken. Gedetailleerde onderzoeksresultaten zullen zijn gepubliceerd in Moleculaire therapie.
Tijdens de COVID-19-pandemie hebben mRNA-vaccins een uitstekende werkzaamheid getoond, waarbij miljarden doses wereldwijd zijn toegediend. Door de snelle ontwikkeling ervan zijn er echter problemen ontstaan, met name wat betreft relatief sterke, waaronder ernstige bijwerkingen, die nog steeds belangrijke problemen vormen.
Hoewel deze bijwerkingen aanvaardbaar kunnen worden geacht voor een beperkt aantal doses tijdens een pandemie, is een veiliger platform dat meerdere doses gedurende het hele leven mogelijk maakt, wenselijk voor voortdurende COVID-19-boosters en de uitbreiding van de toepassing van mRNA-vaccins naar andere infectieziekten. De huidige mRNA-vaccins zijn in verband gebracht met bijwerkingen, voornamelijk toegeschreven aan lipide nanodeeltjes (LNP’s) die het mRNA dragen (mRNA gehuld in een lipidelaag).
LNP’s bezitten immunostimulerende eigenschappen en kunnen uit de injectieplaats stromen, wat leidt tot systemische ontstekingsreacties. Niettemin spelen LNP’s een cruciale rol in de werkzaamheid van vaccins [Function I] het voorkomen van mRNA-afbraak en het efficiënt afleveren van mRNA in cellen, [Function II] migreren naar lymfeklieren om mRNA in immuuncellen af te leveren, en [Function III] het stimuleren van het immuunsysteem via immunostimulerende lipiden. De huidige studie heeft tot doel deze functies te verkrijgen zonder afhankelijk te zijn van LNP’s.
Deze studie biedt een eenvoudig en veilig ontwerp, de toediening van naakt mRNA. Met betrekking tot [Function II]bevinden zich weinig immuuncellen in spierweefsel, een huidige toedieningsplaats van mRNA-vaccins. Daarom werd het huidweefsel, dat overvloediger aanwezig is in immuuncellen, als doelwit genomen.
Verder voor [Function I]gebruikte het onderzoeksteam een jetinjector die de afgifte van mRNA aan de huidcellen vergemakkelijkt door gebruik te maken van fysieke stress veroorzaakt door de jetflow. In een reporterstudie verbeterde Jet Injector de mRNA-afgifte-efficiëntie met meer dan 100 keer vergeleken met een conventionele naald- en spuitinjectie. Ook bleef mRNA op de injectieplaats zonder detecteerbare systemische lekkage.

Aan de andere kant migreerden mRNA-geladen LNP’s (mRNA gehuld in een lipidelaag) na intradermale toediening naar de lever, milt en andere systemische organen, waardoor daar ontstekingen werden veroorzaakt. Bovendien was de ontsteking op de injectieplaats zeer gering in onze methode, terwijl mRNA gehuld in een lipidelaag infiltratie van ontstekingscellen en weefselnecrose induceerde.
Vervolgens demonstreerde het onderzoeksteam eerst het vaccinatievermogen van naakt mRNA met behulp van een modelantigeen. De straalinjector verbeterde de werkzaamheid van de antilichaamproductie drastisch tot een niveau dat vergelijkbaar is met dat van mRNA gehuld in een lipidelaag bij de maximaal toelaatbare doses.
Deze antilichamen bestrijden virussen in het lichaam en voorkomen infecties, maar kunnen geïnfecteerde cellen niet verwijderen. Aan de andere kant verwijdert cellulaire immuniteit dergelijke zieke cellen en speelt een cruciale rol bij het voorkomen van ernstige ziekten. Het is intrigerend dat het naakte mRNA-vaccin effectief het aantal immunocyten verhoogt, zoals CD4-positieve T-cellen en CD8-positieve T-cellen.
Vervolgens voerde het onderzoeksteam virusuitdagingsexperimenten uit na de naakte mRNA-vaccinatie gericht tegen het spike-eiwit van het SARS-CoV-2-virus. De vaccinatie verlaagde de hoeveelheid virus in de longen aanzienlijk en verlichtte de longontsteking vergeleken met een niet-gevaccineerde controle. Dit vaccin voorzag cynomolgusapen van een vaccineffectiviteit die vergelijkbaar was met die van muizen, zonder significante bijwerkingen.
De huidige studie omvat ook mechanistische analyses. Met betrekking tot [Function II]bleef het naakte mRNA-vaccin op de injectieplaats en migreerde het niet naar de lymfeklieren. Aan de andere kant migreerden antigeenpresenterende cellen die mRNA op de injectieplaats opnamen naar de lymfeklieren, wat kan bijdragen aan de werkzaamheid van de vaccinatie.
Het vaccin induceerde inderdaad de rijping van de lymfeklieren nabij de injectieplaats. Voor [Function III]veroorzaakte de Jet Injector een voorbijgaande ontsteking gelokaliseerd op de injectieplaats, waarbij lymfocyten werden gerecruteerd. Naald- en spuitinjectie van naakt mRNA induceerde een dergelijke ontstekingsreactie niet. Deze resultaten suggereren dat de immuunstimulatie door Jet Injector kan functioneren als een fysiek adjuvans om de werkzaamheid van de vaccinatie te verbeteren. Waargenomen lokale ontstekingsreacties verdwenen binnen enkele dagen.
Concluderend kan worden gesteld dat het naakte mRNA-vaccin de systemische bijwerkingen vermindert, een probleem met mRNA gehuld in een lipidelaag, en immuniteit induceert die voldoende is voor de bescherming tegen infectieziekten. Dit is een wereldleidende prestatie in het voorkomen van infectieziekten met alleen mRNA. In de praktijk kan dit vaccin een platform worden dat herhaalde doseringen met kleine bijwerkingen mogelijk maakt. Momenteel worden verdere onderzoeken uitgevoerd, met als doel een klinische proef gepland voor 2026.
Meer informatie:
Saed Abbasi et al., Dragervrij mRNA-vaccin induceert robuuste immuniteit tegen SARS CoV-2 bij muizen en niet-menselijke primaten zonder systemische reactogeniciteit, Moleculaire therapie (2024). DOI: 10.1016/j.ymthe.2024.03.022
Tijdschriftinformatie:
Moleculaire therapie
Geleverd door Innovation Center of NanoMedicine