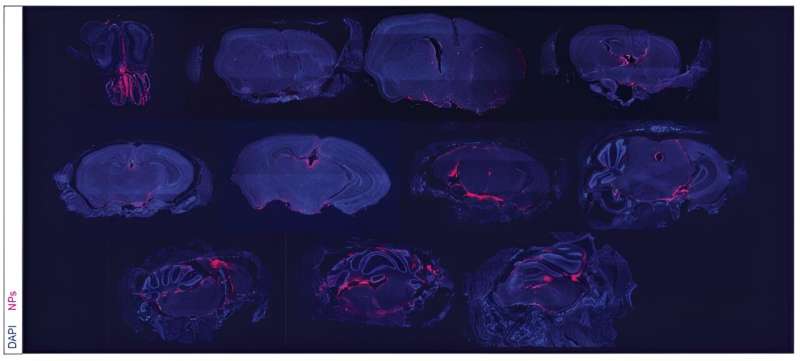
Representatieve verdeling van 90 nm Cy5-NP over representatieve coronale secties van het hoofd 6 uur na icm-aflevering (n = 5, schaalbalk = 700 µm). Credit: Wetenschappelijk translationele geneeskunde (2023). DOI: 10.1126/scitranslmed.adi1617
Met behulp van nanodeeltjes die rechtstreeks in het hersenvocht (CSV) worden toegediend, heeft een onderzoeksteam een behandeling ontwikkeld die aanzienlijke uitdagingen kan overwinnen bij de behandeling van een bijzonder dodelijke hersenkanker.
De onderzoekers, onder leiding van professoren Mark Saltzman en Ranjit Bindra, dienden muizen met medulloblastoom een behandeling toe met speciaal ontworpen nanodeeltjes die medicijnen bevatten. De studie, gepubliceerd in Wetenschappelijk translationele geneeskundetoonde aan dat muizen die deze behandeling kregen significant langer leefden dan muizen in de controlegroep.
Medulloblastoom, een hersenkanker die vooral kinderen treft, begint vaak met een tumor diep in de hersenen. De kanker heeft de neiging zich te verspreiden langs twee beschermende membranen, bekend als de leptomeningen, door het centrale zenuwstelsel, met name het oppervlak van de hersenen en het hersenvocht.
Leptomeningeale verspreiding wordt waargenomen bij een aantal primaire hersentumoren, evenals bij hersenmetastasen van solide tumoren in de borst, longen en andere plaatsen. Omdat er geen anatomische barrières in het hersenvocht zijn die verdere groei voorkomen, kunnen deze vormen van kanker zich snel verspreiden.
Het is moeilijk gebleken om tumoren in het hersenvocht aan te pakken, deels omdat de vloeistof bij mensen ongeveer vier keer per dag snel door het centrale zenuwstelsel circuleert, waarbij antitumormedicijnen doorgaans worden weggespoeld voordat ze de kans hebben gehad zich op te hopen en enig effect te hebben.
“Het is als een watervalsysteem, met een snelle, snelle vloeistofstroom”, zegt Minsoo Khang, hoofdauteur van de studie en voormalig afgestudeerde student in het laboratorium van Saltzman.
Om dit obstakel te omzeilen, vervaardigde het onderzoeksteam nanodeeltjes die zich aan tumoren hechten. Deze nanodeeltjes zijn ontworpen in het laboratorium van Saltzman en zijn gemaakt met afbreekbare polymeren die langzaam een DNA-reparatieremmer vrijgeven, talazoparib, die door de FDA is goedgekeurd en momenteel in de kliniek wordt gebruikt voor een aantal vormen van kanker. Het medicijn behoort tot een relatief nieuwe klasse kankermedicijnen, bekend als PARP-remmers, die een enzym blokkeren dat helpt bij het repareren van DNA. Zonder het vermogen om hun DNA te repareren, is de kans groter dat tumorcellen sterven.
De behandeling met nanodeeltjes wordt intrathecaal geïnjecteerd, dat wil zeggen dat het rechtstreeks wordt toegediend tussen de leptomeningen die de CSF beschermen. Gedurende een periode van weken ontdekten de onderzoekers de aanwezigheid van de nanodeeltjes in het hersenvocht tot wel 21 dagen na een enkele dosis.
“We waren erg opgewonden dat we een medium hadden gevonden dat langdurig retentie heeft in deze vloeibare ruimte, wat anders een uitdaging is”, zei Khang.
De behandeling van hersenkanker in het algemeen is een uitdaging, omdat maar weinig behandelingen de bloed-hersenbarrière kunnen doordringen, een natuurlijk afweersysteem dat potentieel nuttige medicijnen kan blokkeren. De methode van het onderzoeksteam zou uitkomst kunnen bieden.
“Er is heel weinig werk verricht op het gebied van de intrathecale toediening van nanodeeltjes, dus we zijn erg enthousiast omdat we hiermee de leptomeningeale verspreiding van ziekten door hersenmetastasen kunnen aanpakken”, zegt Bindra, hoogleraar Therapeutische Radiologie van Harvey en Kate Cushing en hoogleraar medische radiologie. Pathologie. “Dit heeft echt een geheel nieuwe manier geopend om deze patiënten te behandelen, hoewel er nog veel meer werk moet worden gedaan.”
Door de nanodeeltjes te gebruiken om de tumoren te targeten, konden de onderzoekers het medicijn talazoparib gebruiken, dat effectief is gebleken bij een aantal solide tumoren buiten de hersenen. Omdat het medicijn echter tot geen penetratie in het centrale zenuwstelsel heeft geleid, zou een oraal toegediende dosis een beperkte werkzaamheid hebben tegen tumoren met leptomeningeale verspreiding.
“Door het in te kapselen in een nanodeeltje en het rechtstreeks in de CSF te injecteren, krijgen we nu juist op dat gebied een zeer hoge blootstelling”, zegt Saltzman, hoogleraar Biomedical Engineering, Chemical & Environmental Engineering & Physiology van de Goizueta Foundation, en lid van Yale. Kanker Centrum.
Door het medicijn intrathecaal toe te dienen, wordt ook vermeden dat het rechtstreeks in de hersenen wordt geïnjecteerd, een techniek die convectie-verbeterde toediening wordt genoemd, een zeer uitdagende procedure die slechts een paar keer per jaar kan worden uitgevoerd. Intrathecale injecties zijn daarentegen veel minder invasief en kunnen worden gegeven zonder ziekenhuisopname.
“Dit is enorm voor ons, omdat we nu in de loop van de tijd meerdere behandelingen met nanodeeltjes kunnen uitvoeren”, zei Bindra.
Naast de injectie van nanodeeltjes kregen muizen ook een orale dosis van een chemotherapiemedicijn dat bekend staat als temozolomide.
“Het is een nieuw platform waar we deze orale chemotherapieën kunnen geven die de bloed-hersenbarrière passeren en een doelgericht middel alleen in het centrale zenuwstelsel,” zei Bindra. “In wezen zal deze compartimentering van de combinatietherapie de synergetische tumorceldoding bevorderen en tegelijkertijd de systemische toxiciteit minimaliseren.”
De muizen die de behandeling op basis van nanodeeltjes kregen, leefden aanzienlijk langer dan de muizen die medicamenteuze therapie kregen waarbij geen nanodeeltjes werden gebruikt, en zelfs langer dan de muizen die geen behandeling kregen. Verder was er veel minder verspreiding van de kanker bij de muizen die de medicijndragende nanodeeltjes ontvingen.
De onderzoekers zeiden dat de volgende stappen zullen zijn om de aanpak te valideren in grotere diermodellen, uiteindelijk gevolgd door testen op mensen. Het team is ook van plan de behandelmethode op andere vormen van kanker te testen, vooral op de vormen die zich naar de hersenen verspreiden.
Meer informatie:
Minsoo Khang et al., Intrathecale toediening van PARP-remmer met nanodeeltjes aan het hersenvocht voor de behandeling van metastatisch medulloblastoom, Wetenschappelijk translationele geneeskunde (2023). DOI: 10.1126/scitranslmed.adi1617
Tijdschriftinformatie:
Wetenschappelijk translationele geneeskunde
Geleverd door Yale Universiteit