Grafisch abstract. Credit: Journal of gecontroleerde release (2023). DOI: 10.1016/j.jconrel.2023.03.032
Chemotherapie is een steunpilaar van de behandeling van kanker. Hoewel deze therapie effectief is, doodt ze lukraak snel delende cellen – kankercellen of anderszins – zodat patiënten vaak ernstige bijwerkingen ervaren, waardoor uiteindelijk de bruikbaarheid ervan wordt beperkt.
Maar wat als er een manier was om een inactief chemotherapeuticum door het hele lichaam toe te dienen en het medicijn in een tumor ‘aan te zetten’? Deze strategie zou de bijwerkingen kunnen beperken en mogelijk behandelingen met een hogere dosis (en effectievere) mogelijk maken.
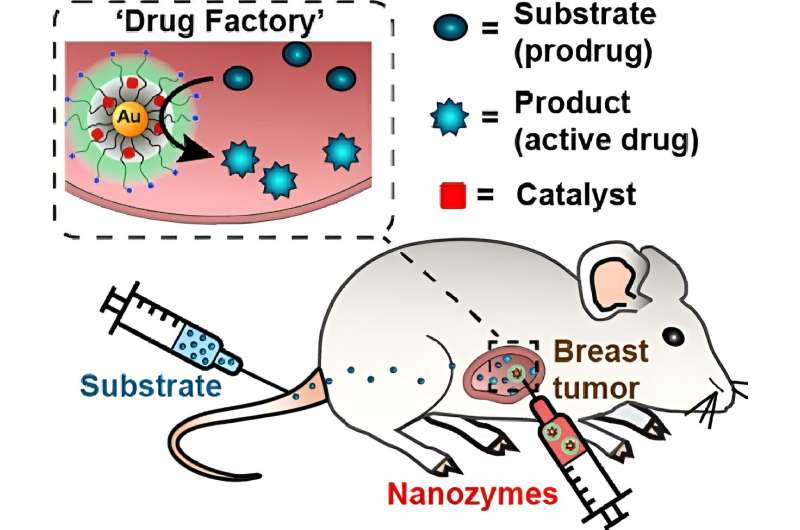
Voer nanozymen in. Deze kunstmatige enzymen, samengesteld uit nanomaterialen, kunnen vooraf bepaalde chemische reacties uitvoeren, zoals het omzetten van een inerte drug (of prodrug) in zijn functionele vorm. Als ze in een tumor worden geïnjecteerd en worden blootgesteld aan een prodrug, kunnen nanozymen gelokaliseerde ‘medicijnfabrieken’ worden, die selectief een kankermedicijn in de tumor activeren en tegelijkertijd schade aan gezond weefsel minimaliseren.
Bio-ingenieurs en scheikundigen van de Universiteit van Massachusetts Amherst (UMass Amherst) hebben een nanozym ontwikkeld dat een inactieve vorm van fluorouracil, een veelgebruikt chemotherapeuticum, in zijn actieve vorm kan veranderen. Wanneer geëvalueerd in een muismodel van borstkanker, zou hun behandeling tumoren net zo effectief kunnen verkleinen als standaard fluorouracil-chemotherapie met aanzienlijk minder leverschade.
Door de chemotherapeutische doses op de tumorplaats te verhogen en niet door het hele lichaam, zou deze strategie mogelijk net zoveel therapeutisch voordeel kunnen bieden als standaardchemotherapie met aanzienlijk minder toxiciteit. De resultaten van deze methode zijn onlangs gerapporteerd in de Journal of gecontroleerde release.
“Het ontwikkelen van gerichte, veiligere therapieën voor kankerbehandelingen zal altijd een belangrijke prioriteit zijn in het veld”, legt Luisa Russell, Ph.D., een programmadirecteur in de afdeling Discovery Science & Technology bij NIBIB uit. “Dit onderzoek demonstreert een manier om een bestaande chemotherapie minder toxisch te maken zonder in te boeten aan werkzaamheid in een preklinisch model van borstkanker. Deze techniek kan met name mogelijk worden toegepast op andere soorten medicijnen, waardoor de weg wordt vrijgemaakt voor gerichte behandelingen voor een verscheidenheid aan verschillende aandoeningen. .”
Hier is hoe de nanozymen zijn ontworpen: ultrakleine gouden nanodeeltjes zijn dicht gecoat met positief geladen moleculen, waardoor ze sterk worden aangetrokken door celoppervlakken (die negatief geladen zijn). Vervolgens wordt een metaalkatalysator, in dit geval palladium, aan de binnenkant van de nanodeeltjes toegevoegd.
Palladium stimuleert de activiteit van de nanozymen en kan bio-orthogonale katalyse uitvoeren (reacties die van nature niet in ons lichaam voorkomen). Palladium kan met name moleculen verwijderen die propargylgroepen worden genoemd en die aan geneesmiddelen kunnen worden toegevoegd om hun activiteit te blokkeren.
“Metaalkatalysatoren, zoals palladium, komen naar voren als een nieuwe manier om selectief prodrugs in biologische systemen te activeren”, zegt senior studieauteur Vincent Rotello, Ph.D., een professor in de chemie aan UMass Amherst.
“Door palladium in te kapselen in onze ultrakleine, positief geladen nanodeeltjes, kunnen we de nanozymen elektrostatisch aan het tumorweefsel ‘klitten’, waardoor de katalysator op zijn plaats wordt verankerd”, legt hij uit. Wanneer een prodrug wordt toegevoegd, reist deze door het lichaam maar wordt geactiveerd in de tumor, waardoor de therapeutische efficiëntie wordt verbeterd en ook de off-target-effecten worden verminderd, voegde hij eraan toe.
Hun behandeling combineert de met palladium gevulde nanozymen met pro-fluorouracil (een versie van het medicijn die is getagd met een propargylgroep). Nadat de nanozymen rechtstreeks in de tumoren zijn geïnjecteerd, krijgen muizen systemisch pro-fluorouracil toegediend (zodat het medicijn door het hele lichaam circuleert). Zodra het medicijn naar de tumor reist, splitsen de nanozymen de propargylgroep af, waardoor het chemotherapeuticum wordt geactiveerd dat vervolgens de omringende cellen doodt.
De onderzoekers vergeleken hun behandeling met nanozyme met standaard fluorouracil bij muizen met borsttumoren. Hoewel beide behandelingen de tumoren aanzienlijk deden krimpen, ervoeren muizen die standaard fluorouracil kregen significant meer leverbeschadiging (wat de meest voorkomende bijwerking is van op fluorouracil gebaseerde chemotherapie).
“Onze met palladium gevulde nanozymen kunnen mogelijk worden gebruikt met elk medicijn of elke verbinding waarvan de activiteit kan worden geblokkeerd door een propargylgroep toe te voegen, ” zei Rotello. “We genereren chemotherapeutica, antimicrobiële middelen en ontstekingsremmers met behulp van deze strategie.” Hij merkte ook op dat andere metaalkatalysatoren aan de nanozymen kunnen worden toegevoegd (die verschillende bio-orthogonale reacties kunnen uitvoeren die extra prodrugs activeren).
“Hoewel onze strategie enige verfijning nodig heeft voordat deze bij mensen kan worden geëvalueerd, geloof ik dat door nanozyme gefaciliteerde medicijnafgifte een potentiële gamechanger kan zijn voor gerichte, veiligere behandelingen.”
Meer informatie:
Xianzhi Zhang et al, Bioorthogonale nanozymen voor beeldvorming en therapie van borstkanker, Journal of gecontroleerde release (2023). DOI: 10.1016/j.jconrel.2023.03.032
Tijdschrift informatie:
Journal of gecontroleerde release
Geleverd door National Institute of Biomedical Imaging and Bioengineering