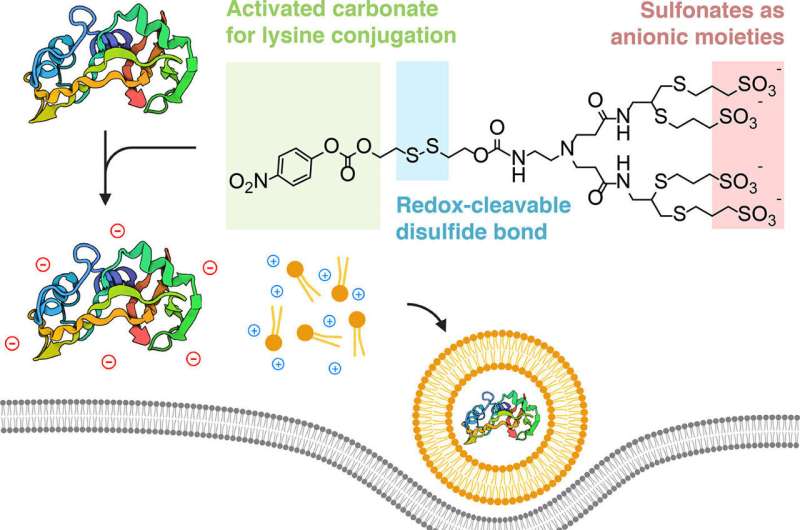
Schematische voorstelling van de bioreversibele anionische verhulstrategie. Chemische modificatie van aan het oppervlak blootgestelde lysinen met gesulfoneerde verhullingsreagentia maakt complexering en daaropvolgende afgifte van eiwitladingen met kationische lipiden mogelijk. Na endocytische ontsnapping worden de reagentia afgesplitst via de aanwezigheid van een zelfverbrandende, redox-gevoelige disulfidebinding om het ladingeiwit spoorloos af te leveren in het cytoplasma van een cel. Credit: ACS Centrale Wetenschap (2024). DOI: 10.1021/acscentsci.4c00071
Een interdisciplinaire samenwerking heeft een manier ontworpen om eiwitten te ‘verhullen’, zodat ze kunnen worden opgevangen door lipide-nanodeeltjes, die lijken op kleine vetbelletjes. Deze belletjes zijn klein genoeg om hun verborgen lading in levende cellen te laten binnendringen, waar de eiwitten zich ontdekken en hun therapeutische effect uitoefenen.
De generaliseerbare techniek zou kunnen leiden tot het herbestemmen van duizenden commerciële eiwitproducten, waaronder antilichamen, voor biologisch onderzoek en therapeutische toepassingen.
Het artikel van de groep, “Bioreversible Anionic Cloaking Enables Intracellulair Protein Delivery with Ionizable Lipid Nanoparticles”, gepubliceerd 14 mei binnen ACS Centrale Wetenschap. De hoofdauteur is promovendus Azmain Alamgir, die werkt in de laboratoria van de co-senior auteurs van het artikel, Chris Alabi, universitair hoofddocent chemische en biomoleculaire technologie bij Cornell Engineering, en Matt DeLisa, de William L. Lewis hoogleraar Engineering en directeur van het Cornell Instituut voor Biotechnologie.
Het project begon met één enkel doel: het combineren van de expertise van de DeLisa-groep op het gebied van het ontwerpen van op eiwitten gebaseerde therapieën met de focus van het Alabi-lab op de intracellulaire levering van biologische geneesmiddelen.
Als sommige medicijnen de biologie van een cel willen beïnvloeden en uiteindelijk ziekten willen behandelen, moeten ze de cel binnendringen en een specifieke ruimte bereiken. Dit is vergelijkbaar met het repareren van een kapotte leiding in een huis: de loodgieter moet een bepaalde kamer betreden om het lek te repareren.
Op eiwitten gebaseerde therapieën hebben veel voordelen – ze kunnen specifiekere effecten hebben, met een lagere toxiciteit en een verminderde immuunrespons – maar het gemak van toediening is daar niet één van. Eiwitten zijn groot en omslachtig en diffunderen niet zo gemakkelijk in cellen als kleine moleculen. Dat is één van de redenen waarom kleine moleculen de belangrijkste bron van medicijnen zijn in de farmaceutische industrie: ze kunnen gemakkelijk in cellen diffunderen zonder een transportmiddel.
Door de jaren heen heeft DeLisa’s groep een breed scala aan interessante en potentieel effectieve kandidaat-eiwitgeneesmiddelen ontwikkeld. Helaas werd de praktische bruikbaarheid van deze eiwitten beperkt door de afwezigheid van een methode voor intracellulaire afgifte. Hoewel gentherapie – een biomedische technologie die een therapeutisch effect kan hebben door een gen voor expressie in doelcellen af te leveren – een optie was, heeft de methode een bewogen geschiedenis vanwege veiligheidsproblemen bij mensen.
“We waren op zoek naar een slimme manier om onze gemanipuleerde eiwitten efficiënt in cellen te krijgen, vooral in een translationele context die niet alleen zou werken in in het laboratorium gekweekte cellen, maar die ook effectief en veilig zou zijn in diermodellen en uiteindelijk bij mensen. ’, zei DeLisa.
“Toen Azmain onze groep met de groep van Chris verbond, was een van de ideeën die naar boven kwamen: waarom dit als gentherapie aanbieden als we het als een reeds gemaakt eiwit zouden kunnen leveren? En dat maakte ons erg enthousiast.”
Alabi’s laboratorium had zijn eigen uitdagingen. Hoewel het team ervaring had met het afleveren van nucleïnezuren in cellen met behulp van nanodeeltjes, moesten ze volgens Alabi nog een manier vinden om hetzelfde te doen met “bolvormige, zachte eiwitten” vanwege de beperkte ervaring van het laboratorium met het produceren van voldoende hoeveelheden van de eiwitten om te testen.
“We zagen dit als een mooie brug tussen onze onderzoeksgroepen, om deze nieuwe ruimte te creëren waar volgens mij op dat moment niet veel mensen aan werkten, en om het te doen op een manier die schaalbaar en impactvol zou kunnen zijn”, zei Alabi. .
De onderzoekers hadden het brede idee om een bioconjugatiebenadering te gebruiken waarmee de eiwitten in lipide-nanodeeltjes kunnen worden geladen, die zich rond nucleïnezuren vormen. Een groot voordeel van deze aanpak was dat lipidenanodeeltjes een sleutelcomponent vormden in de succesvolle COVID-19-vaccins ontwikkeld door Pfizer-BioNTech en Moderna.
“Destijds kwam die technologie echt van de grond”, zei Alamgir.
Die vaccins werkten door een lading af te leveren in de vorm van messenger-RNA, dit zijn nucleïnezuren. De onderzoekers zouden nu hetzelfde concept voor de afgifte van lipide-nanodeeltjes gebruiken – dezelfde materialen zelfs – maar met een eiwitlading. De truc zou zijn om eiwitten meer op nucleïnezuren te laten lijken.
De onderzoekers ontdekten dat ze dit konden bereiken door de eiwitten te ‘verhullen’ met een negatief geladen ion, zodat ze zich elektrostatisch met de positief geladen lipiden zouden verbinden.
“De kern van onze strategie is conceptueel heel eenvoudig”, zei Alamgir. “We nemen eiwitten en hermodelleren specifiek hun oppervlakken met negatieve ladingen, zodat ze op nucleïnezuren lijken en op dezelfde manier kunnen worden samengevoegd tot nanodeeltjes wanneer ze worden geformuleerd met de karakteristieke lipiden.”
Eén probleem dat het team tegenkwam, was dat de omstandigheden waaronder nucleïnezuren worden geformuleerd om zich te verbinden met of te complexeren met de lipiden behoorlijk hard zijn – te hard voor eiwitten.
“We moesten mildere omstandigheden gebruiken en een licht gewijzigde formulering waarbij we extra lipiden toevoegden”, zei Alabi. “Dus zowel aan de kant van de bioconjugatie van eiwitten als aan de kant van de lipiden moesten we de formulering aanpassen om dit zo goed mogelijk te laten werken.”
Het team, waaronder promovendus en co-auteur Souvik Ghosal, demonstreerde met succes de verhulmethode met lysine-reactieve gesulfoneerde verbindingen, waarbij kankercellen werden gedood met ribonuclease A en tumorsignalering werd geremd met monoklonale immunoglobuline G (IgG) antilichamen.
Een bijkomend voordeel van de door het team gebruikte bioconjugatiechemie is dat het proces omkeerbaar is. De chemische tag die aan het eiwit wordt toegevoegd, verdwijnt zodra het het cytoplasma van de cel is binnengedrongen. En omdat de bioconjugatiemethode zich richt op lysine – een type aminozuur dat overvloedig voorkomt in natuurlijke eiwitten – kan de techniek voor vrijwel elk eiwit worden gerepliceerd.
“Dit heeft de potentie om veel kant-en-klare eiwitten die momenteel verkrijgbaar zijn bij veel life science-distributeurs en biotechnologiebedrijven te gebruiken en deze opnieuw te gebruiken voor nieuwe intracellulaire toepassingen”, aldus Alamgir.
Meer informatie:
Azmain Alamgir et al., Bioreversibele anionische cloaking maakt intracellulaire eiwitlevering mogelijk met ioniseerbare lipide nanodeeltjes, ACS Centrale Wetenschap (2024). DOI: 10.1021/acscentsci.4c00071
Tijdschriftinformatie:
ACS Centrale Wetenschap
Geleverd door Cornell Universiteit