
Credits: elenabsl/Shutterstock
Gentherapie is een mogelijke behandelingsmethode voor een breed scala aan ziekten die worden veroorzaakt door genetische mutaties. Hoewel het een gebied van divers en intensief onderzoek is geweest, zijn historisch gezien slechts een paar patiënten behandeld met behulp van gentherapie – en nog minder genezen. De komst van de genetische modificatietechniek genaamd CRISPR-Cas9 in 2012 heeft een revolutie teweeggebracht in gentherapie, evenals in de biologie als geheel, en het is onlangs begonnen met klinische proeven voor de behandeling van sommige ziekten bij mensen.
Haruno Onuma, Yusuke Sato en Hideyoshi Harashima van Hokkaido University hebben een nieuw leveringssysteem voor CRISPR-Cas9 ontwikkeld, gebaseerd op lipide nanodeeltjes (LNP’s), dat de efficiëntie van in vivo gentherapie aanzienlijk zou kunnen verhogen. Hun bevindingen werden gepubliceerd in de Journal of gecontroleerde release.
“Er zijn grofweg twee manieren om ziekten te behandelen met gentherapie,” legde Sato uit, “ex vivo, waarbij cellen in het laboratorium worden onderworpen aan de gewenste modificaties en vervolgens bij de patiënt worden ingebracht, en in vivo, waar de behandeling wordt toegediend aan de patiënt. patiënt om de cellen in hun lichaam te veranderen. Veilige en effectieve in-vivobehandeling is de ultieme ambitie van gentherapie, aangezien het een ongecompliceerd proces zou zijn voor patiënten en zorgverleners. LNP’s kunnen functioneren als een voertuig voor de veilige en effectieve toediening van dergelijke therapieën.”
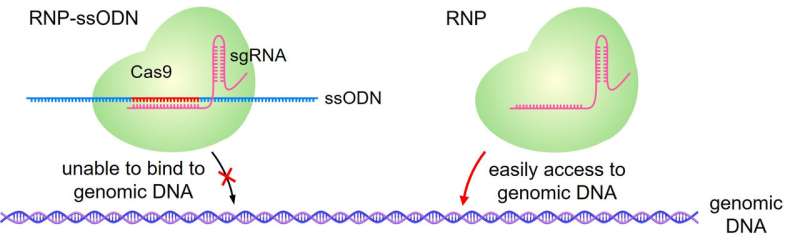
De RNP-ssODN is ontworpen om ervoor te zorgen dat het CRISPR-Cas9-molecuul wordt ingekapseld door de LNP. Eenmaal in de cellen dissocieert de ssODN en kan CRISPR-Cas9 zijn effect uitvoeren. Credit: Journal of gecontroleerde release (2023). DOI: 10.1016/j.jconrel.2023.02.008
CRISPR-Cas9 bestaat uit een groot molecuul dat is samengesteld uit het Cas9-eiwit en gids-RNA. Het gids-RNA bindt zich aan een specifieke, complementaire DNA-sequentie en het Cas9-eiwit knipt die sequentie door, waardoor deze kan worden gewijzigd. Het gids-RNA kan worden gewijzigd om zich te richten op specifieke DNA-sequenties die moeten worden gewijzigd.
“In een eerdere studie ontdekten we dat aanvullende DNA-moleculen, ssODN’s genaamd, ervoor zorgen dat het CRISPR-Cas9-molecuul in de LNP’s (CRISPR-LNP’s) wordt geladen”, licht Harashima toe. “In deze studie hebben we opnieuw ssODN’s gebruikt, maar ze waren zorgvuldig ontworpen zodat ze de functie van het gids-RNA niet zouden remmen.”
Met behulp van een gids-RNA gericht op de expressie van een eiwit genaamd transthyretine, evalueerden ze de effectiviteit van de CRISPR-LNP’s in muismodellen. CRISPR-LNP’s met ssODN’s die dissocieerden van het gids-RNA bij kamertemperatuur waren het meest effectief in het verminderen van serumtransthyretine: twee opeenvolgende doses, met een tussenpoos van een dag, verminderden het met 80%.
“We hebben de optimale ssODN-sequentieaffiniteit aangetoond die zorgt voor het laden en vrijgeven van CRISPR-Cas9 op de doellocatie en dat dit systeem kan worden gebruikt om cellen in vivo te bewerken”, concludeert Onuma. “We zullen doorgaan met het verbeteren van het ontwerp van ssODN’s en het ontwikkelen van optimale lipideformuleringen om de effectiviteit van de toediening te vergroten.”
Meer informatie:
Haruno Onuma et al., Op lipiden gebaseerde ribonucleoproteïne-afgifte op basis van nanodeeltjes voor in vivo genoombewerking, Journal of gecontroleerde release (2023). DOI: 10.1016/j.jconrel.2023.02.008
Tijdschrift informatie:
Journal of gecontroleerde release
Aangeboden door de Universiteit van Hokkaido