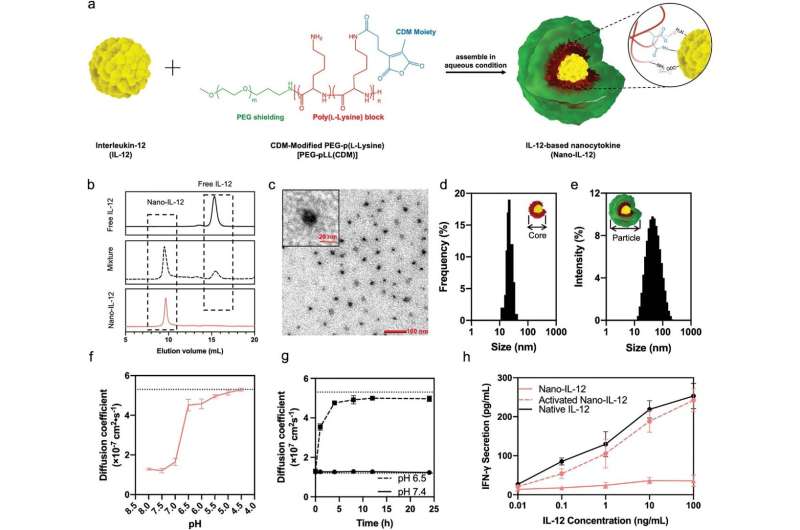
Nano-IL-12 wordt geactiveerd bij intratumorale pH om het volledig actieve cytokine vrij te maken. a) Vorming en structuur van op IL-12 gebaseerde nanocytokine (Nano-IL-12). De Nano-IL-12 is zelf-geassembleerd in waterige omstandigheden door simpelweg het polymeer te mengen met IL-12. De assemblage wordt aangedreven door de pH-gevoelige amidebindingen en elektrostatische interacties. b) HPLC-resultaten van vrij IL-12-eiwit, PEG-pLL(CDM) + IL-12-mengsel en gezuiverd Nano-IL-12. De IL-12-eiwitten zijn gelabeld met A647. c) Representatief TEM-beeld van gezuiverd Nano-IL-12 toont duidelijk de kernstructuur van de deeltjes. d) Verdeling van de diameter van de deeltjeskernen gemeten op basis van de TEM-afbeeldingen. N = 100 deeltjes geteld. e) Verdeling van de hydrodynamische diameters van Nano-IL-12 gemeten door DLS. f) pH-afhankelijke Nano-IL-12-dissociatie aangegeven door FCS-meting van Nano-IL-12 geïncubeerd onder verschillende pH gedurende 24 uur. De stippellijn op 5,3 × 107 cm2 S−1 verwijst naar de diffusiecoëfficiënt van vrij IL-12. g) IL-12-afgifteprofiel van Nano-IL-12 gemeten met de FCS-methode. De stippellijnen op 1,2 × 107 cm2 S−1 en 5,3 × 107 cm2 S−1 verwijs naar de diffusiecoëfficiënten van respectievelijk intact Nano-IL-12 en vrijgegeven vrij IL-12. h) IFN-y uitscheiding door muriene splenocyten behandeld met Nano-IL-12, geactiveerde Nano-IL-12 en native IL-12. IFN-y werd gemeten door ELISA. Gegevens worden weergegeven als gemiddelde ± SD; voor f en g, N = 3 parallelle metingen. Voor H, N = 5 parallelle metingen. Credit: Geavanceerde wetenschap (2023). DOI: 10.1002/advs.202205139
Een groep onder leiding van prof. Horacio Cabral ontdekte in samenwerking met een groep onder leiding van prof. Kazuhiro Kakimi een nieuwe manier om kankerimmunotherapie te verbeteren. Hun bevindingen zijn gepubliceerd in een paper, getiteld “An IL-12-Based Nanocytokine Safely Potentiates Anticancer Immunity through Spatiotemporal Control of Inflammation to Eradicate Advanced Cold Tumors”, in Geavanceerde wetenschap.
Veel solide tumoren hebben een immunosuppressieve micro-omgeving, die de infiltratie, activering en effectorfunctie van immuuncellen voorkomt, wat resulteert in een immunologisch koud tumorfenotype dat ongevoelig is voor immunotherapie uitgevoerd door immuuncontrolepuntremmers (ICI’s), waaronder de beroemde anti-PD-1 en anti-CTLA-4-antilichamen.
Interleukine-12 (IL-12) is een van de sterkste pro-inflammatoire cytokines. Er is dus een groot belang om het te gebruiken voor het versterken van de immuniteit in tumoren en het verbeteren van de responspercentages van immunotherapieën. IL-12 is echter extreem toxisch vanwege systemische immuunactivatie en vertoont beperkte klinische werkzaamheid bij een veilige dosis. Om een dergelijk probleem op te lossen, werd hier een op IL-12 gebaseerde nanocytokine ontwikkeld die de immuunactiveringsfunctie van IL-12 op basis van intratumorale pH kan regelen om een tumorgerichte immuniteitsverbetering te realiseren.
Gebaseerd op pH-gevoelige polymeermaterialen, kan de nanocytokine de pH in tumoren voelen om de volledig actieve cytokine te ontketenen. Dientengevolge vermijdt de nanocytokine de systemische respons gemedieerd door IL-12 en vermindert het de bijwerkingen. In het muriene triple-negatieve borstkankermodel (TNBC) verbetert de nanocytokine de immuniteit en verhoogt het het infiltratieniveau van de immuuncellen in de tumor. De nanocytokine geeft ook kracht aan ICI’s, waardoor zowel primaire als uitgezaaide tumoren volledig worden uitgeroeid.
Wat is de nieuwigheid van deze studie?
IL-12 is lang onderzocht als potentiële middelen tegen kanker, maar de sterke toxiciteit en onvoldoende therapeutische werkzaamheid bij maximaal getolereerde doses werden geïllustreerd door klinische onderzoeken in een vroeg stadium en vroegen om strategieën om dit probleem op te lossen voordat het werd toegepast. De formulering van nanocytokine is het eerste voorbeeld van een op polymeren gebaseerd schakelbaar IL-12-toedieningssysteem, en in de resultaten van deze studie werd gevonden dat:
- Een op polymeer gebaseerde nanocytokine-formulering kan de “uit” en “aan”-toestand van de biologische activiteit van IL-12 stabiel regelen door het pH-verschil tussen gezonde organen en tumor te detecteren.
- De op de tumor gerichte activering van de nanocytokine leidt tot spatiotemporele controle van de immuunreacties gemedieerd door IL-12. In gezonde weefsels zijn de off-target immuunactivatie en tegenactieve reacties verminderd, terwijl in de tumor de ontstekingsreacties zijn versterkt.
- De nanocytokine ontsteekt koude tumoren diepgaand vanaf het genexpressieniveau en werkt samen met ICI’s om geavanceerde primaire en metastatische tumoren volledig uit te roeien.
Waarom zijn deze bevindingen belangrijk en hoe gaat de studie de huidige therapie verbeteren?
Interleukine-12 (IL-12) is een van de sterkste pro-inflammatoire cytokines. Er is dus een groot belang om het te gebruiken voor het ontsteken van tumoren en het verhogen van de responspercentages van immunotherapieën. Desalniettemin is IL-12 uiterst giftig vanwege systemische immuunactivering en vertoont het een beperkte klinische werkzaamheid, zelfs bij de maximaal getolereerde dosis (MTD), omdat de spatiotemporele ontstekingsdynamiek ervan immuunreacties tegengaat.
Hoewel er grote inspanningen worden geleverd om IL-12-eiwit te ontwikkelen om de veiligheid en tumorselectiviteit te vergroten, schieten deze benaderingen tekort om de problemen van IL-12 op te lossen, omdat ze nog steeds systemische ontsteking kunnen veroorzaken, interfererende ontstekingsremmende signalen kunnen bevorderen en, in veel gevallen , vertonen een lagere equimolaire activiteit dan natief IL-12. Helaas wordt de inflammatoire dynamiek voor dergelijke door eiwitten ontworpen systemen nog steeds slecht begrepen, en de bevordering van tegenwerkende secundaire reacties blijft onduidelijk.
De op IL-12 gebaseerde nanocytokine lost de genoemde problemen in één keer op door de spatiotemporele controle van de ontsteking te bevorderen door hoge tumoraccumulatie, hoge en selectieve intratumorale immuunactiviteit en gereguleerde interactie met de systemische immuniteit. Aldus controleerde nanocytokine de ontsteking op een spatiotemporele manier.
Het blokkeerde de systemische immuunrespons en vermeed het optreden van adaptieve ontstekingsremmende signalen na herhaalde injectie, bijv. de uitbreiding van interleukine-10 (IL-10), die gewoonlijk worden waargenomen na de tweede injectie van IL-12 of standaard IL- 12-gebaseerde systemen, zoals fusie-eiwitten en immunocytokinen. Een dergelijke spatiotemporele controle zou gunstig kunnen zijn voor het realiseren van herhaalde toedieningsschema’s zonder dat de antitumoreffecten afnemen.
De nanocytokine breidde ook het therapeutische venster van IL-12 uit door de spatiotemporele controle van ontsteking. De nanocytokine profiteerde dus van de blokkering van tegenactieve immuunresponsen om de effectieve dosis tegen immunosuppressieve triple-negatieve borstkanker met een factor 10 te verlagen. Bovendien verbeterde de nanocytokine de veiligheid en was niet-toxisch, zelfs bij een dosis die 1000 keer hoger is dan de gerapporteerde MTD van natief IL-12 in studies bij mensen.
De nanocytokine ontstoken immunosuppressieve tumoren diep en vermijdt de stimulatie van immuunresponsen die de werkzaamheid verstoren. Hierdoor kon de nanocytokine sterk synergiseren met immuuncontrolepuntremmers (ICI’s) door de immunosuppressieve micro-omgeving van de tumor om te keren.
Met name omdat de nanocytokine is gebaseerd op biocompatibele, door de FDA goedgekeurde materialen, biedt de strategie een groot potentieel voor klinische vertaling. Bovendien zou de formulering kunnen worden uitgebreid naar andere therapeutische eiwitten, die dienen als een praktische strategie voor tumorgerichte toediening van biologische geneesmiddelen.
Meer informatie:
Pengwen Chen et al., Een op IL-12 gebaseerde nanocytokine versterkt op veilige wijze de immuniteit tegen kanker door middel van spatiotemporele controle van ontstekingen om gevorderde koude tumoren uit te roeien, Geavanceerde wetenschap (2023). DOI: 10.1002/advs.202205139
Tijdschrift informatie:
Geavanceerde wetenschap
Aangeboden door Innovatiecentrum van NanoMedicine