Intracellulair onderzoek van FRET NPD’s. Krediet: Tohoku University
De meeste medicijnafgiftesystemen gebruiken nanodragers om medicijnen te transporteren vanwege hun kleine formaat en het vermogen om medicijnen te distribueren naar anders ontoegankelijke plaatsen van het lichaam. De keerzijde van dit kleine formaat is echter dat er grote hoeveelheden nodig zijn om aan de vereiste dosering te voldoen.
Alternatieve dragervrije systemen, bekend als nanoprodrugs (NPD), tonen een enorme belofte voor de behandeling van kanker. Een SN-38 NPD heeft bijvoorbeeld ongeveer 10 keer hogere antikankerefficiëntie dan in de handel verkrijgbare geneesmiddelen. Nu hebben onderzoekers voor het eerst een uitgebreide studie ontwikkeld over de dynamiek van SN-38 NPD’s in kankercellen, inclusief hun internalisatiesnelheid, intracellulaire lokalisatie en afbraak, evenals hun therapeutische efficiëntie.
“Deze innovatieve systemen vertonen een hoge antikankeractiviteit, maar de kennis die fundamenteel is voor klinische vertaling, zoals hun interactie met kankercellen, ontbrak nog”, zegt professor Hitoshi Kasai, co-auteur van de studie.
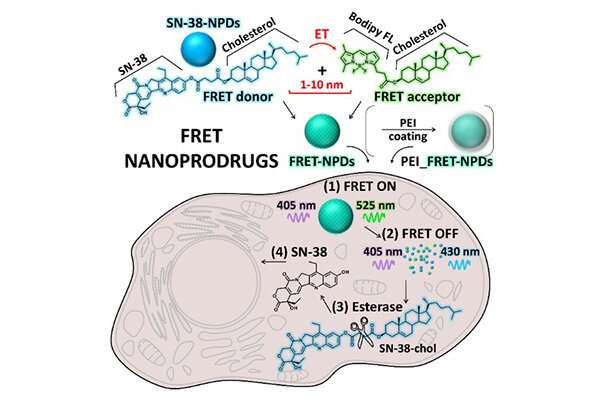
Het onderzoeksteam evalueerde de toestand van NPD’s in kankercellen met behulp van de op Förster Resonance Energy Transfer (FRET) gebaseerde microscopietechniek. FRET is gebaseerd op de energieoverdracht tussen twee lichtgevoelige moleculen. Door gebruik te maken van de fluorescerende eigenschap van de SN-38 samen met de Bodipy FL-fluorescentiesonde in de NPD’s die speciaal voor deze studie waren ontworpen, stelde FRET de onderzoekers in staat de toestand van NPD’s te observeren van intact deeltje tot de opgeloste pro-drug.
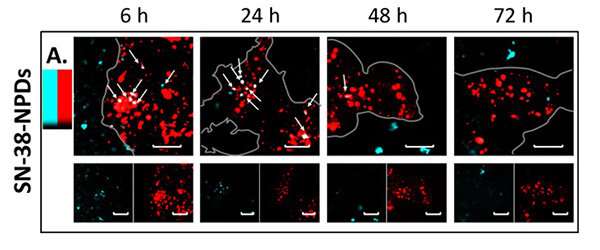
Fluorescentiebeelden van NPD’s (in blauw) die in de loop van de tijd co-lokaliseren en degraderen in lysosomen (in rood). Krediet: Tohoku University
Confocale lasermicroscopie-observatie bevestigde een significante NPD-degradatie van intacte toestand naar een opgelost pro-geneesmiddel in de cellen na verloop van tijd. Dit betekent dat NPD’s consequent door cellen werden geabsorbeerd als intacte deeltjes voordat ze naar de lysosomen werden getransporteerd – een membraangebonden organel met spijsverteringsenzymen. Eenmaal in de lysosomen loste de SN-38-prodrug op uit een intact deeltje (Figuur 2) en voerde het zijn therapeutische effecten uit op de kankercellen.
Kasai voegt eraan toe dat “Ons werk een uitgebreid overzicht biedt van de dynamiek van prodrug nanodeeltjes in kankercellen, waardoor verdere vooruitgang mogelijk is naar hun toepassing als de volgende generatie antikankermedicijnen.”
Farsai Taemaitree et al. FRET-gebaseerd intracellulair onderzoek van nanoprodrugs naar zeer efficiënte afgifte van geneesmiddelen tegen kanker, Nanoschaal (2020). DOI: 10.1039 / D0NR04910G
Nanoschaal
Geleverd door Tohoku University