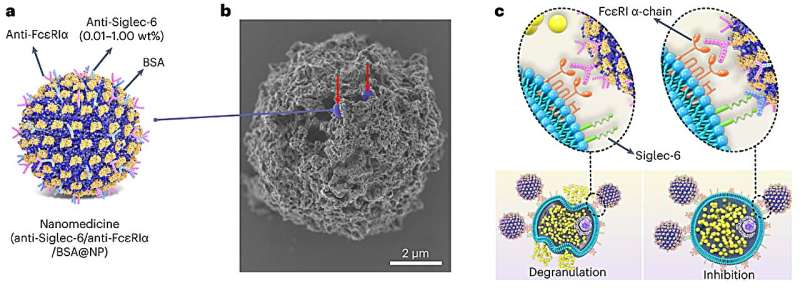
a, op PPSU gebaseerde nanogeneesmiddelen bestaande uit gecoadsorbeerd anti-Siglec-6 (lichtblauw), anti-FcεRIα (roze) en BSA (blokker, geel) met een gecontroleerde oppervlaktedichtheid (als gew.% van PPSU) van anti- Siglec-6. b, Beeldvorming van de nanomedicijnen (blauw, aangegeven door de rode pijlen) op het oppervlak van een MC (grijs) door SEM. Er werden drie onafhankelijke testmonsters bereid en gebruikt voor beeldvorming. c, Activering van MC’s (links) wordt bereikt via de verknoping van FcεRIα door anti-FcεRIα/BSA@NP, terwijl het nanogeneesmiddel MC-degranulatie remt (rechts) via co-gelokaliseerde betrokkenheid van FcεRIα en Siglec-6. Credit: Natuur Nanotechnologie (2024). DOI: 10.1038/s41565-023-01584-z
Onderzoekers van de Northwestern University hebben de eerste selectieve therapie ontwikkeld om allergische reacties te voorkomen, die in ernst kunnen variëren van jeukende netelroos en tranende ogen tot ademhalingsproblemen en zelfs de dood.
Om de nieuwe therapie te ontwikkelen, versierden onderzoekers nanodeeltjes met antilichamen die in staat zijn specifieke immuuncellen (mestcellen genoemd) uit te schakelen die verantwoordelijk zijn voor allergische reacties. Het nanodeeltje bevat bovendien een allergeen dat overeenkomt met de specifieke allergie van de patiënt. Als iemand allergisch is voor bijvoorbeeld pinda’s, dan draagt het nanodeeltje een pinda-eiwit in zich.
Bij deze tweestapsbenadering schakelt het allergeen de precieze mestcellen in die verantwoordelijk zijn voor de specifieke allergie, en vervolgens sluiten de antilichamen alleen die cellen af. Door deze zeer gerichte aanpak kan de therapie selectief specifieke allergieën voorkomen zonder het gehele immuunsysteem te onderdrukken.
In een muizenstudie toonde de therapie 100% succes aan bij het voorkomen van allergische reacties zonder merkbare bijwerkingen te veroorzaken.
Het onderzoek is gepubliceerd vandaag (16 januari) in het dagboek Natuur Nanotechnologie. Het is de eerste nanotherapie die mestcellen remt en zo een allergische reactie op een specifiek allergeen voorkomt.
“Momenteel zijn er geen methoden beschikbaar om specifiek mestcellen te targeten”, zegt Evan A. Scott van Northwestern, die het onderzoek leidde. ‘Het enige dat we hebben zijn medicijnen zoals antihistaminica om symptomen te behandelen, en die voorkomen geen allergieën. Ze gaan de effecten van histamine tegen nadat de mestcellen al zijn geactiveerd.
“Als we een manier zouden hebben om de mestcellen die reageren op specifieke allergenen te inactiveren, dan zouden we gevaarlijke immuunreacties in ernstige situaties zoals anafylaxie kunnen stoppen, maar ook minder ernstige reacties zoals seizoensallergieën.”
“De grootste onvervulde behoefte betreft anafylaxie, die levensbedreigend kan zijn”, zegt dr. Bruce Bochner van Northwestern, allergie-expert en co-auteur van het onderzoek. “Bepaalde vormen van orale immunotherapie kunnen in sommige gevallen nuttig zijn, maar we hebben momenteel geen door de FDA goedgekeurde behandelingsopties die dergelijke reacties consequent voorkomen, behalve het vermijden van het aanstootgevende voedsel of middel. Anders worden behandelingen zoals epinefrine gegeven om ernstige aandoeningen te behandelen.” reacties – niet voorkomen.
“Zou het niet geweldig zijn als er een veilige en effectieve behandeling voor voedselallergie bestond die het consequent mogelijk maakt om voedsel opnieuw in het dieet te introduceren dat je voorheen strikt moest vermijden?”
Scott is de Kay Davis hoogleraar biomedische technologie aan de McCormick School of Engineering in Northwestern en lid van het Simpson Querrey Institute for BioNanotechnology en van het International Institute for Nanotechnology. Bochner is emeritus hoogleraar geneeskunde (allergie en immunologie) van Samuel M. Feinberg aan de Northwestern University Feinberg School of Medicine.
De eerste auteur van het artikel is Fanfan Du, een postdoctoraal onderzoeker in het laboratorium van Scott, die nauw samenwerkte met co-eerste auteurs Clayton Rische, een Ph.D. kandidaat mede-gementeerd door zowel Bochner als Scott, en Yang Li, een Ph.D. kandidaat in het Scott-lab.
Lastig doelwit
Mestcellen bevinden zich in bijna alle weefsels van het menselijk lichaam en zijn vooral bekend omdat ze in de eerste plaats verantwoordelijk zijn voor allergische reacties. Maar ze spelen ook verschillende andere belangrijke rollen, waaronder de regulering van de bloedstroom en het bestrijden van parasieten. Daarom zou het volledig elimineren van mestcellen om allergische reacties te voorkomen schadelijk kunnen zijn voor andere nuttige, gezonde reacties.
“Hoewel sommige medicijnen in ontwikkeling zijn, zijn er momenteel geen door de FDA goedgekeurde medicijnen die mestcellen remmen of elimineren,” zei Bochner. “Dit was vooral moeilijk omdat medicijnen die de activering of overleving van mestcellen kunnen beïnvloeden, zich ook op andere cellen dan mestcellen richten, en dus de neiging hebben ongewenste bijwerkingen te hebben als gevolg van invloeden op andere cellen.”
In eerder werk identificeerde Bochner Siglec-6, een unieke remmende receptor die in hoge mate en selectief op mestcellen wordt aangetroffen. Als onderzoekers die receptor met een antilichaam zouden kunnen targeten, zouden ze mestcellen selectief kunnen remmen om allergie te voorkomen. Maar de introductie van dit antilichaam op zichzelf was niet voldoende.
“Het was moeilijk om een concentratie van het antilichaam te krijgen die hoog genoeg was om effect te hebben,” zei Scott. “We vroegen ons af of we deze concentratie konden verhogen met behulp van een nanodeeltje. Als we een hoge dichtheid aan antilichamen op een nanodeeltje zouden kunnen verpakken, zouden we het praktisch voor gebruik kunnen maken.”
Antilichamen op een deeltje plakken
Om de antilichamen op een nanodeeltje te verpakken, moesten Scott en zijn team nog een uitdaging overwinnen. Om eiwitten (zoals antilichamen) aan een nanodeeltje te laten hechten, moeten ze doorgaans een chemische binding vormen die het eiwit ontvouwt (of denatureert), waardoor de biologische activiteit ervan wordt beïnvloed. Om deze uitdaging te omzeilen, wendde Scott zich tot een nanodeeltje dat eerder in zijn laboratorium was ontwikkeld.
In tegenstelling tot meer standaard nanodeeltjes met stabiele oppervlakken, bestaat het nieuw ontwikkelde nanodeeltje van Scott uit dynamische polymeerketens, die onafhankelijk van richting kunnen veranderen bij blootstelling aan verschillende oplosmiddelen en eiwitten. Wanneer ze in vloeibare oplossingen worden gebracht, oriënteren de ketens zich om gunstige elektrostatische interacties met watermoleculen te bereiken.
Maar wanneer een eiwit het oppervlak van het nanodeeltje raakt, veranderen de specifieke kleine polymeerketens aan het grensvlak van richting om het eiwit stabiel vast te houden zonder er covalent aan te binden. Het team van Scott ontdekte ook dat waterafstotende holtes op eiwitoppervlakken de sleutel waren tot de stabiele interactie.
Bij binding aan oppervlakken denatureren eiwitten doorgaans, waardoor hun bioactiviteit verloren gaat. Een uniek aspect van de nanodeeltjes van Scott is dat ze op stabiele wijze enzymen en antilichamen kunnen binden, terwijl ze hun 3D-structuur en biologische functies behouden. Dit betekent dat de anti-Siglec-6-antilichamen hun sterke affiniteit voor de mestcelreceptoren behielden, zelfs wanneer ze aan de oppervlakken van nanodeeltjes waren gehecht.
“Dit is een uniek dynamisch oppervlak”, zei Scott. “In plaats van een standaard stabiel oppervlak kan het de oppervlaktechemie veranderen. Het is gemaakt van kleine polymeerketens van verbindingen, die hun oriëntatie kunnen omdraaien om indien nodig gunstige interacties met zowel water als eiwitten te maximaliseren.”
Toen het team van Scott de nanodeeltjes mengde met antilichamen, hechtte bijna 100% van de antilichamen zich met succes aan de nanodeeltjes zonder hun vermogen om zich aan hun specifieke doelwitten te binden te verliezen. Dit resulteerde in een op nanodeeltjes gebaseerde therapie waarbij gebruik werd gemaakt van oppervlakken met dicht opeengepakte en zeer controleerbare hoeveelheden van meerdere verschillende antilichamen tegen mestcellen.
Selectieve afsluiting
Om ervoor te zorgen dat iemand allergisch wordt, vangen en vertonen hun mestcellen antilichamen, met name immunoglobuline E (IgE) antilichamen, voor dat specifieke allergeen. Hierdoor kunnen de mestcellen bij hernieuwde blootstelling hetzelfde allergeen herkennen en erop reageren.
“Als je een pinda-allergie hebt en in het verleden een reactie op pinda’s hebt gehad, dan maakten je immuuncellen IgE-antilichamen tegen pinda-eiwitten, en de mestcellen verzamelden ze”, zei Scott. “Nu wachten ze tot je nog een pinda eet. Als je dat doet, kunnen ze binnen enkele minuten reageren, en als de reactie sterk genoeg is, kan dit leiden tot anafylaxie.”
Om selectief mestcellen te targeten om op een bepaald allergeen te reageren, ontwierpen de onderzoekers hun therapie om alleen mestcellen aan te spreken die IgE-antilichamen tegen dat allergeen dragen. Het nanodeeltje maakt gebruik van een eiwitallergeen om in te grijpen met IgE-antilichamen op de mestcellen en gebruikt vervolgens een antilichaam om de Siglec-6-receptor in te schakelen om het reactievermogen van de mestcel uit te schakelen. En omdat alleen mestcellen Siglec-6-receptoren vertonen, kan het nanodeeltje zich niet binden aan andere celtypen – een strategie die bijwerkingen effectief beperkt.
“Je kunt elk allergeen gebruiken dat je wilt, en je zult selectief de reactie op dat allergeen uitschakelen”, zei Scott. ‘Normaal zou het allergeen de mestcel activeren. Maar tegelijkertijd bindt het allergeen zich, het antilichaam op het nanodeeltje maakt ook gebruik van de remmende Siglec-6-receptor. Gegeven deze twee tegenstrijdige signalen besluit de mestcel dat deze niet moet worden geactiveerd en moet dat allergeen met rust laten. Het stopt selectief een reactie op een specifiek allergeen. Het mooie van deze aanpak is dat het niet vereist dat alle mestcellen worden gedood of geëlimineerd. En, vanuit veiligheidsoogpunt, als het nanodeeltje zich per ongeluk aan de verkeerde celtype, die cel reageert gewoon niet.”
Voorkomen van anafylaxie bij muizen
Na het aantonen van succes in cellulaire culturen met behulp van van menselijk weefsel afkomstige mestcellen, verplaatsten de onderzoekers hun therapie naar een gehumaniseerd muismodel. Omdat mestcellen bij muizen de Siglec-6-receptor niet hebben, ontwikkelde het team van Bochner een muismodel met menselijke mestcellen in hun weefsels. De onderzoekers stelden de muizen bloot aan een allergeen en gaven tegelijkertijd de nanotherapie.
Geen enkele muis ondervond een anafylactische shock en ze overleefden allemaal.
“De eenvoudigste manier om een allergische reactie te monitoren is het volgen van veranderingen in de lichaamstemperatuur,” zei Scott. “We zagen geen veranderingen in de temperatuur. Er kwam geen reactie. Bovendien bleven de muizen gezond en vertoonden ze geen uiterlijke tekenen van een allergische reactie.”
“Mestcellen van muizen hebben geen Siglec-6 op hun oppervlak zoals bij mensen, maar we zijn voor nu zo dicht mogelijk bij daadwerkelijke studies bij mensen gekomen door deze nanodeeltjes te testen in speciale muizen die menselijke mestcellen in hun weefsels hadden,” zei Bochner. . “We konden aantonen dat deze gehumaniseerde muizen beschermd waren tegen anafylaxie.”
Vervolgens zijn de onderzoekers van plan hun nanotherapie te onderzoeken voor de behandeling van andere mestcelgerelateerde ziekten, waaronder mastocytose, een zeldzame vorm van mestcelkanker. Ze onderzoeken ook manieren om medicijnen in de nanodeeltjes te laden om selectief mestcellen bij mastocytose te doden zonder andere celtypen te beschadigen.
Meer informatie:
Fanfan Du et al., Gecontroleerde adsorptie van meerdere bioactieve eiwitten maakt gerichte mestcel-nanotherapie mogelijk, Natuur Nanotechnologie (2024). DOI: 10.1038/s41565-023-01584-z
Tijdschriftinformatie:
Natuur Nanotechnologie
Geleverd door Northwestern University