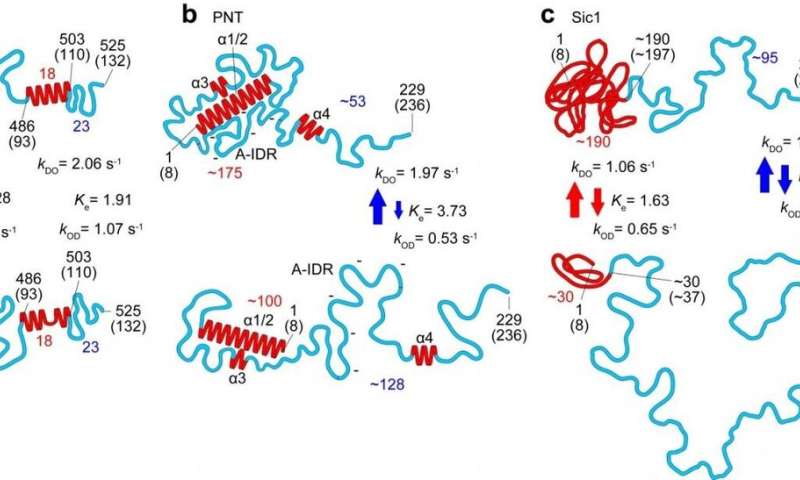
Structurele en dynamische kenmerken van drie IDP’s (N.STAART, PNT en Sic1) onthuld door HS-AFM-beeldvorming. De bovenste en onderste panelen komen overeen met respectievelijk de meer geordende en minder geordende staten. De nummers in rood en blauw staan voor het aantal aminozuren dat aanwezig is in respectievelijk de respectievelijke gevouwen gebieden en volledig ongeordende gebieden. De rode en blauwe pijlen geven respectievelijk de kinetische aard aan van veranderingen in hoogte van gevouwen gebieden en de end-to-end afstand van volledig ongeordende gebieden. Krediet: Kanazawa University
Ons begrip van biologische eiwitten hangt niet altijd samen met hoe vaak of belangrijk ze zijn. De helft van alle eiwitten, moleculen die een integrale rol spelen in celprocessen, is intrinsiek verstoord, wat betekent dat veel van de standaardtechnieken voor het onderzoeken van biomoleculen er niet op werken. Nu hebben onderzoekers van de Kanazawa University in Japan aangetoond dat hun zelfgekweekte, supersnelle atoomkrachtmicroscopietechnologie niet alleen informatie kan verschaffen over de structuren van deze eiwitten, maar ook over hun dynamiek.
Als u begrijpt hoe een eiwit is samengesteld, krijgt u waardevolle aanwijzingen voor de functies ervan. De ontwikkeling van eiwitkristallografie in de jaren dertig en vijftig bracht voor het eerst verschillende eiwitstructuren in beeld, maar geleidelijk werd het duidelijk dat een groot deel van de eiwitten geen enkele vaste structuur heeft, waardoor ze onhandelbaar zijn voor röntgenkristallografie. Omdat ze te dun zijn voor elektronenmicroscopie, zijn de enige haalbare alternatieven voor veel van deze intrinsiek gestoorde eiwitten (IDP’s) nucleaire magnetische resonantiebeeldvorming en röntgenstraalverstrooiing met kleine hoek. Gegevens die met deze technieken worden verzameld, worden gemiddeld over ensembles en geven dus geen duidelijke indicatie van individuele eiwitconformaties of hoe vaak ze voorkomen. Atoomkrachtmicroscopie daarentegen is in staat tot biologische beeldvorming op nanoschaal met hoge snelheid, zodat het zowel dynamiek als eiwitstructuren kan vastleggen.
In dit laatste werk pasten onderzoekers van de Kanazawa University, samen met medewerkers in Japan, Frankrijk en Italië de techniek toe op de studie van verschillende IDP’s en identificeerden ze parameters die de vorm, grootte en ketenlengte van eiwitregio’s definiëren, evenals een machtswet die betrekking heeft op de eiwitgrootte. naar de eiwitlengte, en een kwantitatieve beschrijving van het effect van het mica-oppervlak op eiwitafmetingen. De dynamiek van de eiwitconformaties vastgelegd dankzij de snelle mogelijkheden van de techniek onthulde bolletjes die verschijnen en verdwijnen, en transformaties tussen volledig ongestructureerde en losjes gevouwen conformaties in segmenten tot 160 aminozuren lang.
Met name studies van het nucleoproteïne van het mazelenvirus hielpen niet alleen de vorm en afmetingen te identificeren, maar ook de kenmerken van de volgorde-wanorde-overgangen in de regio die verantwoordelijk is voor moleculaire herkenning, waardoor virussen gastheerfactoren kunnen identificeren zodat ze zich kunnen voortplanten. Ze zouden ook structuren op grotere schaal van het fosfoproteïne van het virus kunnen bepalen die niet toegankelijk zijn voor nucleaire magnetische resonantie (wat alleen een indicatie kan geven van afstanden tussen aminozuren die minder dan 2 nm van elkaar zijn gescheiden). De onderzoekers suggereren dat de vorming van bepaalde waargenomen compacte vormen de weerstand tegen proteolyse – eiwitafbraak – kan verklaren.
In hun rapport van het werk benadrukken de onderzoekers dat, naast een krachtig instrument op zich, “wanneer alle moleculaire kenmerken onthuld door HS-AFM worden gecombineerd met de gevouwen lokale structuur gegeven door NMR, de gecombineerde informatie een kwantitatieve afbakening mogelijk maakt. van de structurele en dynamische karakters van IDP’s, op een meer realistische manier vergeleken met de afbeeldingen afzonderlijk afgebeeld, zoals aangetoond voor PNT [measles virus phosphoprotein]. “
Atoomkrachtmicroscopie met hoge snelheid
Atoomkrachtmicroscopie werd ontwikkeld in de jaren tachtig en bracht de resolutie op atomaire schaal bereikt door scanning tunneling microscopie (die de Nobelprijs voor natuurkunde in 1986 won) naar niet-geleidende monsters. Het werkt met een kleine cantilever met een punt op nanoschaal aan het uiteinde, die het oppervlak aanvoelt als een naald van een vinylplaat of erop tikt. Of het nu gaat om het aanpassen van de tiphoogte of de resonantiefrequentie van het tikken, de interacties tussen tip en oppervlak leveren een signaal op dat kan worden gebruikt om een beeld te genereren.
Hoewel AFM-beelden biologisch onderzoek enorme voordelen opleverden, konden deze onderzoeken weer een versnelling hoger schakelen toen Toshio Ando en zijn team van de Kanazawa University een atoomkrachtmicroscoop rapporteerden die met hoge snelheid werkte. Op atoomschaalresolutie gebaseerde beelden werden films die niet alleen structuren maar ook dynamiek binnen handbereik brachten. Eerder werk aan geordende eiwitten, die redelijk goed worden begrepen, en de IDP faciliteert chromatine transcriptie (FACT) -eiwit, heeft aangetoond dat de techniek kan worden gebruikt om deze biomoleculen af te beelden zonder effecten van contact tussen tip en monster die de gegevens vervormen.
Intrinsiek ongeordende eiwitten
De komst van röntgenkristallografie gaf onderzoekers voor het eerst een duidelijk beeld van een groot aantal biomolecuulstructuren. Maar met de honderdduizenden biomolecuulstructuren die met behulp van eiwitkristallografie zijn geanalyseerd sinds de techniek voor het eerst in de jaren dertig en vijftig van de vorige eeuw in gebruik werd genomen, begon zich steeds meer bewijs te ontwikkelen dat niet alle eiwitten een enkele vaste structuur hebben. De waarnemingen waren in strijd met het heersende paradigma van eiwitfunctie bepaald door een vaste structuur.
In de afgelopen tien tot twintig jaar is de alomtegenwoordigheid van deze intrinsiek gestoorde eiwitten en hun belang in celfuncties van signalering tot de regulatie van transcriptie en daaropvolgende translatie algemeen erkend. In het huidige werk bestuderen de onderzoekers IDP’s, waaronder polyglutamine kanaalbindend proteïne-1 (PQBP-1, betrokken bij verschillende processen, zoals pre-mRNA-splitsing, transcriptieregulatie, aangeboren immuniteit en neuronontwikkeling), autofagie-eiwitten (die zijn geïnovolieerd bij het verwijderen disfunctionele celcomponenten) die intrinsiek wanordelijke regio’s (IDR’s) en het mazelenvirus-nucleoproteïne bevatten.
Noriyuki Kodera et al, Structurele en dynamische analyse van intrinsiek ongeordende eiwitten door atoomkrachtmicroscopie met hoge snelheid, Natuur Nanotechnologie (2020). DOI: 10.1038 / s41565-020-00798-9
Natuur Nanotechnologie
Geleverd door Kanazawa University