
De beperkende factor bij kankerradiotherapie is dat doses die hoog genoeg zijn om tumoren te genezen, ook de omliggende normale weefsels beschadigen. Krediet: Shutterstock
Kanker is wereldwijd de tweede belangrijkste doodsoorzaak. In 2018 waren er 18,1 miljoen nieuwe gevallen en 9,5 miljoen kankergerelateerde sterfgevallen wereldwijd. Tegen 2040 zal het aantal nieuwe kankergevallen per jaar naar verwachting stijgen tot 29,5 miljoen en het aantal kankergerelateerde sterfgevallen tot 16,4 miljoen.
Ongeveer 50 procent van alle kankerpatiënten kan baat hebben bij radiotherapie bij de behandeling van hun ziekte. Ongeveer de helft van die patiënten is vroeg genoeg gediagnosticeerd zodat hun kanker te genezen is. Voor veel kankers, waaronder borst-, prostaat-, baarmoederhals-, hoofd- en nek-, long- en hersenkanker, omvat curatieve behandeling bestralingstherapie. Omdat radiotherapie echter zowel gezonde cellen als tumorcellen vernietigt, zijn de doses beperkt.
Radiotherapie, ook wel bestralingstherapie genoemd, wordt alleen gebruikt om kanker te behandelen of in combinatie met andere behandelingsopties zoals chemotherapie en chirurgie. Het kan ook worden gebruikt om de tumor vóór de operatie te verkleinen. Bij radiotherapie worden tumorcellen – die zich veel sneller delen dan andere omliggende gezonde cellen – vernietigd door hun DNA te beschadigen.
Bijwerkingen beperken stralingsdosis
De beperkende factor bij radiotherapie is dat doses die hoog genoeg zijn om risicovolle (lokaal gevorderde) niet-gemetastaseerde tumoren te genezen, ook de omliggende normale weefsels beschadigen. Momenteel zitten we aan de limiet van de radiotherapiedosis die aan patiënten kan worden gegeven. Om de overleving verder te verbeteren, is er behoefte aan nieuwe methoden die de stralingseffectiviteit verbeteren en de bijwerkingen verminderen.
Een manier om dit te bereiken is door tumorcellen gevoeliger te maken voor straling, zodat die cellen gemakkelijker worden beschadigd door bestralingstherapie. Gebruik makend van gouden nanodeeltjes als radiosensitizers heeft veelbelovende resultaten opgeleverd. Deze gouden nanodeeltjes kunnen intraveneus worden ingebracht om zich op te hopen in de tumor door gebruik te maken van de defecte wanden van de bloedvaten van de tumor, die de neiging hebben om te lekken vanwege de snelle groei.
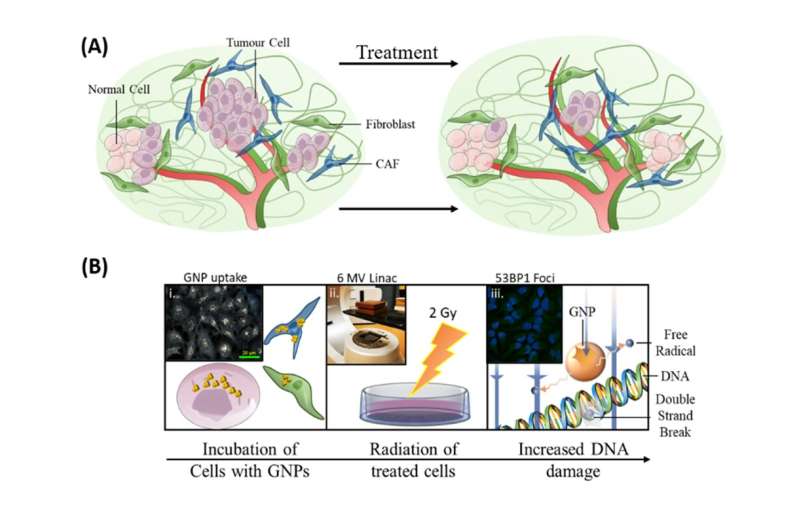
Het opnemen van gouden nanodeeltjes in de huidige protocollen voor bestralingsbehandeling had drie doelen: het doden van tumorcellen verbeteren, CAF’s targeten en fibroblasten beschermen. Credit: Bromma et al. (2020), Sci Reports, 10, 2181., Auteur verstrekt
Gouden nanodeeltjes interageren met röntgenfotonen die worden gebruikt bij stralingsbehandeling, die elektronen produceren, die vervolgens een interactie aangaan met watermoleculen om vrije radicalen te produceren. Deze vrije radicalen kunnen cellen beschadigen, waardoor de overleving van die cellen wordt verminderd.
Het begrijpen van het complexe biologische systeem dat aanwezig is in en rond de tumor is essentieel voor het optimaliseren van het gebruik van de radiosensibiliserende BNP’s, zoals geschetst door een consortium van laboratoria, inclusief ons eigen laboratorium voor nanowetenschap en technologieontwikkeling aan de Universiteit van Victoria.
Gerichte interacties binnen de tumor
In dit werk bespreken we het belang van het onderzoeken welke cellulaire componenten in de micro-omgeving van de tumor de gouden nanodeeltjes opnemen en radiosensibiliseren. We zijn met name geïnteresseerd in cellen die geactiveerde fibroblasten worden genoemd, die worden geassocieerd met wondgenezing en antitumorogene eigenschappen hebben, wat betekent dat ze tumorgroei helpen bestrijden.
Geactiveerde fibroblasten kunnen echter door de tumorcellen worden gerekruteerd en kanker-geassocieerde fibroblasten (CAF’s) worden. In plaats van antitumorogene eigenschappen bevorderen CAF’s de proliferatie en metastase van tumoren.
De functie van CAF’s ondersteunt het idee dat tumoren “wonden zijn die niet genezen”, en het richten op CAF’s kan gunstig zijn voor betere resultaten van kankerbehandelingen.
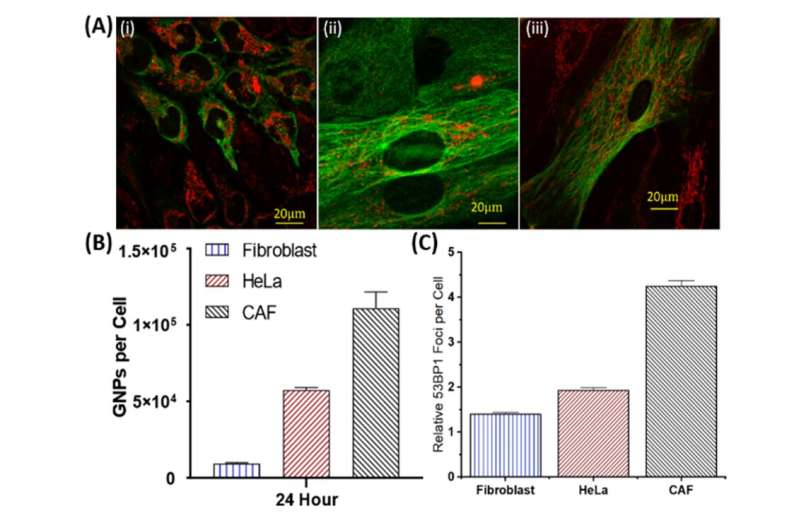
Accumulatie van gouden nanodeeltjes (rood) in de tumoromgeving. Credit: Bromma et al. (2020), Sci Reports, 10, 2181., Auteur verstrekt
Zoals geïllustreerd in de afbeelding hierboven, had ons onderzoek naar het opnemen van gouden nanodeeltjes in de huidige protocollen voor bestralingsbehandeling drie doelen: het doden van tumorcellen verbeteren, CAF’s targeten en fibroblasten beschermen.
Om radiosensibilisatie effectief te laten zijn bij het verbeteren van de stralingsbehandeling, moeten de cellen waarop de behandeling gericht is (de cellen die geassocieerd worden met de groei van kanker) een hoge opname van de radiosensibiliserende deeltjes hebben, terwijl de gunstige cellen een lage opname moeten hebben. Hierdoor worden de beoogde cellen gemakkelijker vernietigd door bestralingstherapie in doses die patiënten kunnen verdragen.
Deze resultaten met behulp van 3D-tumoren die in het laboratorium zijn gekweekt, zijn zeer bemoedigend. De CAF’s hadden de grootste opname van de gouden nanodeeltjes per cel, met bijna drie keer die van kankercellen, terwijl fibroblasten een relatief klein aantal hadden. Dit vertaalde zich ook in een grotere toename van DNA-schade in de CAF’s in vergelijking met de andere celtypen, waardoor de activiteit van de CAF’s werd verminderd en de tumorgroei werd vertraagd.
Dit verschil in DNA-schade als gevolg van selectieve targeting van kanker-geassocieerde cellen op normale cellen kan ertoe leiden dat gouden nanodeeltjes een effectief hulpmiddel zijn bij toekomstige kankerbestralingstherapie, waardoor schade aan normaal weefsel wordt geminimaliseerd en de lokale bestralingstherapiedosis voor de tumor wordt verbeterd.
Deze studie laat zien dat het gebruik van gouden nanodeeltjes als radiosensitizer het mogelijk maakt om meer schade aan de CAF’s te verspreiden, een element waarvan is aangetoond dat het grotendeels invloedrijk op de progressie van kanker. Wij zijn van mening dat dit werk in de nabije toekomst een bouwsteen zal zijn voor een effectiever behandelregime. Het bouwen van een model dat de verschillende interacties die plaatsvinden in de micro-omgeving van de tumor nauwkeurig kan weergeven, is essentieel om de behandelingsresultaten voor patiënten te verbeteren.
Geleverd door The Conversation