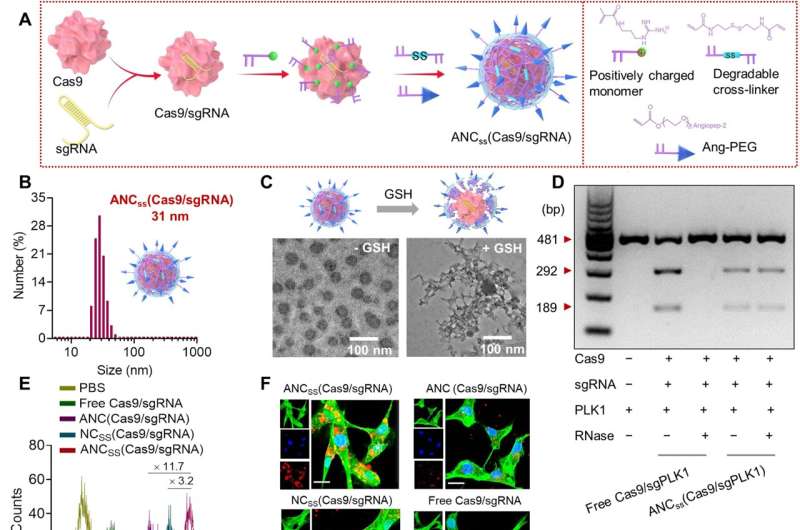
Fabricage, fysieke eigenschappen en cellulaire functie van Cas9/sgRNA-nanocapsules. (A) In situ vrije radicalen polymerisatie werd gebruikt om disulfide-verknoopte nanocapsules te synthetiseren die Cas9/sgRNA bevatten en gefunctionaliseerd met angiopep-2 targeting ligand. (B) Grootteverdeling van ANCSS(Cas9/sgRNA) nanocapsules bepaald door dynamische lichtverstrooiing. (C) TEM-afbeeldingen van ANCSS(Cas9/sgRNA) met of zonder GSH-behandeling. (D) Gelelektroforese-analyse van de ANCSS(Cas9/sgPLK1) of gratis Cas9/sgPLK1 met of zonder RNase-behandeling (1 mg/ml, 30 min). (E) Flowcytometrie van U87MG-cellen na een incubatie van 4 uur met ANCSS(Cas9/sgRNA) of controles. (F) Confocale laser scanning microscopie (CLSM) beelden van U87MG-cellen na 4 uur incubatie met ANCSS(Cas9/sgRNA) of controles. Cas9 was gelabeld met Alexa Fluor 647 (AF647; rood); het cytoskelet werd gekleurd met Alexa Fluor 488 (groen) en de kernen werden gekleurd met Hoechst 33342 (blauw). Voor (E) en (F) was de AF647-Cas9-concentratie 20 nM. Schaalbalken, 20 m. (G) Luciferase-genbewerkingsefficiëntie in U87MG-Luc-cellen geïncubeerd met ANCSS(Cas9/sgRNA) of controles gedurende 72 uur. Gegevens worden weergegeven als gemiddelden ± SD (n = 5; *P SS(Cas9/sgPLK1) of controles gedurende 48 uur. (I) Schema van genbewerking in de kern. (J) Expressieniveaus van PLK1 in U87MG-cellen na 72- uur incubatie met ANCSS(Cas9/sgPLK1) of bedieningselementen. (K) Apoptose-assay van U87MG-cellen na 72 uur incubatie met ANCSS(Cas9/sgRNA) en andere controles. Voor (G) tot (K) was de Cas9-concentratie 20 nM. bp, basenparen; PBS, fosfaatgebufferde zoutoplossing. Credit: wetenschappelijke vooruitgang (2022). DOI: 10.1126/sciadv.abm8011
Een internationaal team van onderzoekers heeft een nanocapsule ontwikkeld die de bloed-hersenbarrière (BBB) kan passeren om de CRISPR-Cas9-bewerkingstool voor de behandeling van een hersentumor te dragen. In hun artikel gepubliceerd in het tijdschrift wetenschappelijke vooruitgang, de groep beschrijft hoe ze hun capsule hebben gemaakt en hoe goed het werkte toen het werd getest op muizen met een glioblastoom.
Glioblastomen zijn notoir moeilijk te behandelen. De tumoren verschijnen in de hersenen en hun groei beschadigt weefsel. Behandelingsopties omvatten chirurgische verwijdering, directe injecties van therapieën die bedoeld zijn om de kankercellen te doden of het inbrengen van CRISPR-virussen in de bloedbaan. Elk van deze opties heeft een keerzijde, van beschadigd hersenweefsel tot ineffectiviteit als gevolg van problemen met therapieën die de BBB passeren. In deze nieuwe poging hebben de onderzoekers een nieuwe benadering geprobeerd, waarbij ze een nanocapsule gebruiken om de CRISPR-Cas9-bewerkingstool naar de hersentumor te brengen, waar het zich richt op een gen dat verantwoordelijk is voor de ontwikkeling van nieuwe cellen – een capsule die in staat is om veilig oversteken van de BB.
De schaal van de nanocapsule is gemaakt met behulp van een disulfide, verknoopt polymeer dat vervolgens werd bezaaid met een angiopep-2-peptide. Het peptide werd toegevoegd om een neutrale oppervlaktelading te creëren zodat het niet zou worden aangevallen door ribonuclease. De schaal was net groot genoeg om een Cas9-complex te bevatten, maar nog steeds klein genoeg (ongeveer 30 nanometer lang) om het door de BBB te laten gaan.
De onderzoekers testten hun nanocapsule-afgiftesysteem in glioblastoma-muismodellen. Elk kreeg een enkele staartinjectie – sommigen ontvingen het nieuw ontwikkelde nanocapsule-afgiftesysteem, terwijl anderen een controle kregen. De onderzoekers ontdekten dat de muizen die de nieuwe therapie kregen een gemiddelde overlevingstijd hadden van 68 dagen, vergeleken met 24 dagen voor de controlegroep. Ze vonden ook een ongewenste genetische mutatie van minder dan 0,5% in ander hersenweefsel.
De onderzoekers suggereren dat hun werk een nieuwe stap is in de richting van niet-invasieve en niet-virale benaderingen voor de behandeling van glioblastomen, hoewel ze erkennen dat er nog veel meer werk moet worden verzet voordat kan worden bepaald of dezelfde benadering zowel veilig als effectief zal zijn bij mensen.
Yan Zou et al, Bloed-hersenbarrière-penetrerende enkele CRISPR-Cas9-nanocapsules voor effectieve en veilige glioblastoma-gentherapie, wetenschappelijke vooruitgang (2022). DOI: 10.1126/sciadv.abm8011
wetenschappelijke vooruitgang