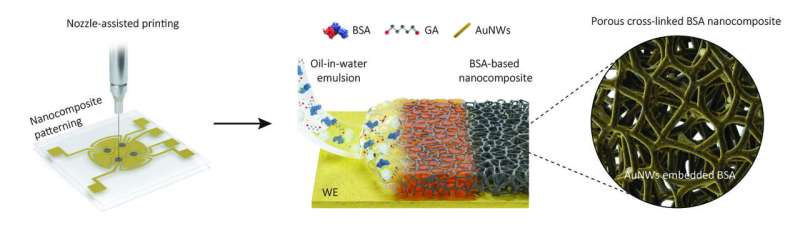
Deze illustratie laat zien hoe de onderzoekers hun dikke, poreuze nanocomposiet antifouling-coating creëerden (van links naar rechts). Met behulp van printen met behulp van spuitmondjes bedekten ze plaatselijk alleen de werkelektrode van een elektrochemische sensor met een olie-in-water-emulsie. Na de verdamping van kleine oliebelletjes blijft er een op runderserumalbumine (BSA) gebaseerde nanocomposiet-scaffold achter met een elektronengeleidend gaas van gouden nanodraad (AuNW) erin ingebed. Krediet: Wyss Instituut aan de Harvard Universiteit
Er wordt aangenomen dat de vergrijzing van de bevolking en de neiging om in veel delen van de wereld een meer sedentaire levensstijl te leiden het aantal mensen met meerdere chronische aandoeningen dramatisch doet toenemen. Bovendien blijven de klimaatverandering en de veranderende patronen in landgebruik en reizen het risico vergroten op infectieziekten die lokaal en mondiaal kunnen ontstaan en zich kunnen verspreiden.
Het snel kunnen diagnosticeren van de aanwezigheid en het beloop van al deze ziekten vormt een groeiende uitdaging voor de gezondheidszorgsystemen – een uitdaging die alleen kan worden aangegaan met behulp van effectieve point-of-care (POC) diagnostische tests die verder gaan dan de spreekkamer en geavanceerde medische zorg. faciliteiten.
POC-testen hebben mensen tijdens de COVID-19-pandemie talloze voordelen opgeleverd, maar deze aanpak moet veel breder toepasbaar worden en artsen en patiënten in staat stellen dieper onderzoek te doen naar pathologische aandoeningen. De huidige POC-diagnostische technologieën meten slechts één enkele ziektebiomarker of soms meerdere biomarkers die tot dezelfde klasse moleculen behoren, zoals verschillende RNA’s, eiwitten of antilichamen.
Het meten van meerdere biomarkers uit verschillende moleculaire klassen zou echter meer informatie kunnen opleveren over de toestand waarin een ziekte zich bevindt, de ernst en het verloop ervan in de loop van de tijd, en zelfs rekening kunnen houden met verschillen van persoon tot persoon in de manier waarop deze zich ontwikkelt.
Elektrochemische biosensoren, die een chemisch signaal in de vorm van een biomarker die aanwezig is in een klein monster biovloeistof, zoals bloed, speeksel of urine, omzetten in een elektrisch signaal dat qua sterkte overeenkomt met de gedetecteerde hoeveelheid biomarker, zouden de mogelijkheid kunnen bieden antwoord op veel diagnostische POC-problemen.
In principe kunnen meerdere sensoren voor verschillende biomarkermoleculen worden gecombineerd in gemultiplexte sensorarrays, en, belangrijker nog, de strijd tegen ‘biofouling’, de voorheen onvermijdelijke ondergang van elektrodeoppervlakken door niet-specifieke biologische moleculen in monsters, is vermijdbaar geworden door de techniek van dunne aangroeiwerende coatings, ontwikkeld door het Wyss Institute van de Harvard University.
Nu heeft het onderzoeksteam van het Wyss Institute, samen met verschillende samenwerkende instituten in Korea, elektrochemische diagnostische detectie een cruciale stap verder gebracht in de richting van een bredere toepassing door een nieuwe nanocomposiet poreuze aangroeiwerende coating te ontwikkelen die met een dikte van één micrometer – de diameter van een bacterie, die ongeveer 100 keer dikker is dan eerdere coatings.
De grotere dikte van de coating en een ontwikkeld poreus netwerk daarin maakten de integratie van veel grotere aantallen biomarker-detecterende probes in sensoren mogelijk, en dus tot 17 keer hogere gevoeligheden dan eerdere best-in-class sensoren, terwijl ze ook superieure antifouling-mogelijkheden boden .
In hun proof-of-concept-studie hebben de onderzoekers sensoren gebouwd die het vermogen combineren om COVID-19-specifieke nucleïnezuur-, antigeen- en gastheerantilichaam-biomarkerdoelen te detecteren in klinische monsters met een hoge gevoeligheid en specificiteit. Hun bevindingen zijn gepubliceerd in Natuurcommunicatie.
“Onze nieuwe dikke poreuze emulsiecoating pakt direct kritische hindernissen aan die momenteel het wijdverbreide gebruik van elektrochemische sensoren als centrale componenten van uitgebreide POC-diagnostiek voor veel aandoeningen verhinderen”, aldus de laatste auteur en Wyss Founding Director Donald Ingber, MD, Ph.D. .
“Maar als we veel verder gaan, zou het ook nieuwe mogelijkheden kunnen bieden voor de ontwikkeling van veiligere en functionelere implanteerbare apparaten en andere gezondheidszorgmonitoringsystemen op meerdere ziektefronten. Het overwinnen van biofouling- en gevoeligheidsproblemen zijn uitdagingen die van invloed zijn op veel van deze inspanningen.”
Ingber is ook de Judah Folkman Professor of Vascular Biology aan de Harvard Medical School en het Boston Children’s Hospital en de Hansjörg Wyss Professor of Bioinspired Engineering aan de Harvard John A. Paulson School of Engineering and Applied Sciences.
Dikkere coating, betere detectie
In 2019 publiceerde het elektrochemische sensorproject van het Wyss Institute zijn eerste baanbrekende artikel waarin melding werd gemaakt van de eerste aangroeiwerende coating met ongekende biosensormogelijkheden.
In een reeks kritische vervolgstudiesbreidde het team het potentieel van elektrochemische detectie uit door de nanochemie van de coatings verder te bevorderen om elektroden nog gevoeliger te maken voor biomarkers, belangrijke multiplexmogelijkheden toe te voegen en kostenverlagende fabricagemethoden te ontwikkelen.
De meest geavanceerde biosensoren die het team in de Wyss heeft ontwikkeld eRapid-platform had een functieset die hun al mogelijk maakt vertaling in sommige klinische settings.
De coatingmethode die het team gebruikte, stelde echter de hele sensorchip bloot aan de nanocomposietoplossing en liet slechts een relatief dunne coating van ongeveer 10 nanometer toe op het gehele sensoroppervlak, wat de functionaliteit van de sensoren op verschillende manieren beperkte.
De dunne diameter van de coating beperkte bijvoorbeeld de maximale hoeveelheid sonde die erin kon worden geladen, wat vooral van cruciaal belang wordt bij grotere multiplexsensoren die nog steeds met kleine monstervolumes moeten werken en nog meer bij pogingen om multiplexsensoren te miniaturiseren voor hun gebruik. in draagbare POC-diagnostische apparaten.
“In dit nieuwe onderzoek hebben we een compleet nieuwe oplossing voor dit probleem bedacht die resulteerde in een 100 keer dikkere coating. Onze nieuwe aanpak maakt gebruik van een inkjetprintmethode waarmee we deze dikke coating zeer lokaal op individuele sensoren kunnen aanbrengen. elementen”, zegt voormalig Wyss Senior Scientist Pawan Jolly, Ph.D., die een belangrijke rol speelde bij de ontwikkeling van het eRapid-platform.
“Dit opent nieuwe mogelijkheden: ten eerste kunnen we veel grotere hoeveelheden biomarker-detecterende probes in de coating opnemen en in de toekomst kunnen de sensoren in complexe arrays individueel worden aangesproken door er nanocomposietchemie op toe te passen die specifiek is gericht op specifieke biomarkermodaliteiten.”
In plaats van elektrochemische elektroden letterlijk in een coatingoplossing te dompelen, zoals ze deden bij hun vorige generatie sensoren, drukten onderzoekers via een fijn mondstuk een laag van een dichte olie-in-water-emulsie op de elektroden. Na het verdampen van de kleine oliebelletjes bleef er een 1 micrometer dikke coating op het elektrodeoppervlak achter die bestond uit verknoopte polymere moleculen van het bloedeiwit albumine en onderling verbonden poriën en elektronengeleidende gouden nanodraden bevatte.
“Het poreuze netwerk in deze nanocomposietcoating vergroot dramatisch het oppervlak dat kan worden gebruikt om specifiek ontworpen biomarker-detecterende sondes aan te bevestigen, en dat tegelijkertijd toegankelijk is voor monstervloeistoffen. Als gevolg daarvan wordt de detectiegevoeligheid aanzienlijk verhoogd.” legde eerste auteur Jeong-Chan Lee, Ph.D., een postdoctoraal onderzoeker in het team van Ingber uit.
“Bovendien stelt het printen van spuitmondjes ons in staat om de emulsie exclusief op de biomarker-detecterende werkelektrode te patrooneren, terwijl de aangrenzende referentie-elektrode in elke sensor er vrij van blijft, wat niet-specifieke elektrische ruis vermindert en de specificiteit van onze metingen verbetert.”
Verder vanaf COVID-19
Het team heeft een eerder ontwikkelde combinatie van detectiereagentia voor drie COVID-19-gerelateerde biomarkers opnieuw gebruikt om een sensorelektrode-array van een patroon te voorzien met behulp van hun nieuw ontwikkelde coatingtechnologie: een CRISPR-compatibele sensor voor een SARS-CoV-2 RNA, een sensorspecifieke sensor. voor een SARS-CoV-2 capside-antigeen, en een sensor voor een virusgericht gastheerantilichaam.
Getest met een verzameling patiëntmonsters, produceerde de nieuwe sensor een 3,75 tot 17 keer hogere detectiegevoeligheid vergeleken met een vorige sensor die met dezelfde detectiesystemen en de beste niet-poreuze, veel dunnere coating van het team was vervaardigd. Het maakte ook onderscheid tussen positieve en negatieve monsters met een nauwkeurigheid van 100% (specificiteit).
“Elektrochemische sensoren met deze coating van de volgende generatie zouden ideaal zijn voor het monitoren van virale uitbraken, vaccinatiereacties en het begrijpen van correlaties tussen verschillende biomarkers in de loop van virale infecties, en in de toekomst zouden ze ook voor andere ziekten kunnen worden gebruikt”, zegt hij. zei Lee.
Meer informatie:
Jeong-Chan Lee et al, micrometerdikke en poreuze nanocomposietcoating voor elektrochemische sensoren met uitzonderlijke aangroeiwerende en elektrisch geleidende eigenschappen, Natuurcommunicatie (2024). DOI: 10.1038/s41467-024-44822-1
Tijdschriftinformatie:
Natuurcommunicatie
Geleverd door de Harvard Universiteit