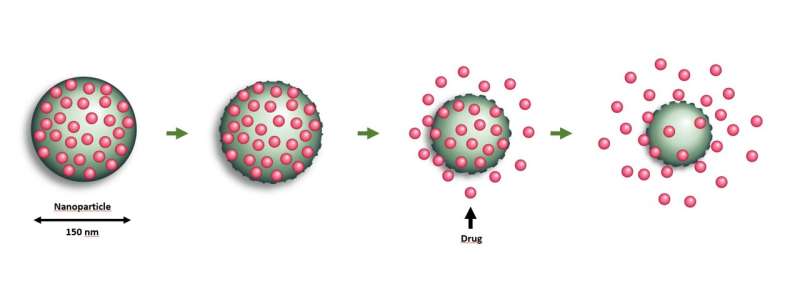
NaDeNo ontwikkelt een technologie waarmee medicijnen met een klein molecuul die normaal gesproken moeilijk aan lichaamsorganen kunnen worden afgeleverd, worden ingebed in kleine dragers van nanodeeltjes. Na injectie brengen de nanodeeltjes het medicijn effectief naar zijn doel, waar de deeltjes worden afgebroken, waardoor het medicijn geleidelijk op de juiste plaats wordt afgegeven. Krediet: SINTEF/NaDeNo
Buikvlieskanker is moeilijk te behandelen en heeft een slechte overlevingsprognose. Maar een nieuw en effectief toedieningssysteem voor nanomedicijnen biedt enige hoop.
Het bedrijf heet NaDeNo en is goed op weg met de ontwikkeling van een nieuwe remedie tegen kanker die zich heeft verspreid naar de buikholte. Het is een spin-off van SINTEF, waar de technologie gedurende een periode van meer dan tien jaar is ontwikkeld binnen nanomedicine-onderzoek.
Het werk waaruit NaDeNo is voortgekomen, begon in 2012. Het eerste onderzoek bij SINTEF leverde veelbelovende resultaten op, en nu worden zowel de technologie als de patenten afgesplitst van het onderzoeksinstituut en ondergebracht in een apart bedrijf.
De technologie maakt het mogelijk om grote hoeveelheden van een actief kankermedicijn in te bedden in dragers van nanodeeltjes. Deze dragers worden vervolgens in de peritoneale holte geïnjecteerd, waardoor het geneesmiddel gelijkmatig kan worden verdeeld en zo kan worden afgegeven aan alle tumoren die zich in het peritoneum hebben ontwikkeld.
Een grote dosis de tumoren afleveren
Experimenten met muizen en ratten tonen aan dat de nanodeeltjes zich bij voorkeur ophopen in de tumoren, waardoor een veel groter deel van het medicijn aan kankercellen wordt afgegeven dan aan gezonde cellen.
“Een solide basis, gecreëerd door onderzoek uitgevoerd bij SINTEF, heeft vooruitgang in de ontwikkeling van deze technologie mogelijk gemaakt”, zegt Ýrr Mørch, Chief Technology Officer (CTO) en mede-oprichter bij NaDeNo. “Als we de resultaten krijgen waarop we hopen, kan de technologie een belangrijke stap voorwaarts zijn, niet alleen voor de toekomstige behandeling van peritoneale kanker, maar ook voor andere ziekten”, zegt hij.
Om de technologie echter toegankelijk te maken voor kankerpatiënten, moet ze eerst grondig worden getest en vervolgens op grotere schaal worden geproduceerd. Het moet zowel veilig als effectief zijn.
“We maken ons nu klaar om preklinische proeven te starten”, zegt Mørch. “Deze fase zal enkele jaren duren, waarin we een aantal dierstudies zullen uitvoeren met behulp van gestandaardiseerde methoden. We moeten het product grondig testen en ook aantonen dat het medicijn veilig is en met de juiste medische zuiverheid kan worden vervaardigd”, zegt hij. .
Het bedrijf zal dan een aanvraag indienen om klinische proeven op kankerpatiënten uit te voeren.
“Nanodeeltjes worden nu op laboratoriumschaal vervaardigd bij SINTEF, maar we moeten laten zien dat we deze op industriële schaal kunnen produceren”, zegt Mørch. “Dit moet worden uitgevoerd door gespecialiseerde fabrikanten, maar daarvoor moeten we naar het buitenland”, zegt hij. “Er moet nog veel onderzoek worden gedaan voordat de technologie kan worden toegepast op kankerpatiënten. We bevinden ons nog in een vroege fase”, zegt hij.
Moeilijk te behandelen peritoneale kanker
Buikvlieskanker is moeilijk te ontdekken en te behandelen. Het ontstaat vaak als gevolg van de verspreiding van kankercellen uit andere organen zoals de eierstokken of het spijsverteringskanaal. Het geeft weinig symptomen en wordt vaak te laat ontdekt. Overlevingsprognoses zijn meestal slecht.
De huidige behandelingsbenaderingen moeten nog worden gestandaardiseerd en zijn eerder levensverlengend dan curatief.
Patiënten die deze diagnose krijgen, worden gewoonlijk behandeld door chirurgische verwijdering van al het zichtbare kankerweefsel, gevolgd door chemotherapie die plaatselijk of via het bloed aan het hele lichaam wordt toegediend. Het probleem met deze benadering is dat het medicijn ofwel een te korte verblijftijd in de peritoneale holte heeft, ofwel de holte en de kankercellen niet bereikt.
“Dit komt door een barrière die bestaat tussen het bloed en het peritoneum”, zegt Annbjørg Falck, CEO en mede-oprichter van NaDeNo.
Om het medicijn effectief te laten werken, moet het oplosbaar zijn in water. Veel chemotherapeutische behandelingen hebben echter betrekking op geneesmiddelen met een klein molecuul die slecht oplosbaar zijn in water. Dergelijke behandelingen zijn dus moeilijk gericht op tumorplaatsen toe te dienen.
Kleine deeltjes met een enorm oppervlak
NaDeNo probeert dit aan te pakken door het medicijn in te kapselen in kleine dragers van nanodeeltjes. De nanodeeltjes worden rechtstreeks in de peritoneale holte geïnjecteerd in een oplossing die ervoor zorgt dat ze gelijkmatig worden verdeeld en alle tumoren in het peritoneum bereiken. Vervolgens geven ze het medicijn af op de tumorplaatsen.
“Dit medicijn is slecht oplosbaar in water als het ‘naakt’ is, maar wordt zeer oplosbaar wanneer het wordt ingebed in de nanocapsules die zijn ontwikkeld door SINTEF”, zegt Mørch. “De capsules helpen het medicijn om de juiste locatie te bereiken. Wanneer de deeltjes in het lichaam worden afgebroken, komt het medicijn vrij”, zegt ze.
In experimenten met muizen en ratten hebben de onderzoekers waargenomen dat de nanodeeltjes zich ophopen in de tumoren in het peritoneum. Hierdoor kan een groter deel van het medicijn de kankercellen bereiken en wordt er minder verspild aan de gezonde cellen.
“De uniforme verdeling van het medicijn door de peritoneale holte, gecombineerd met de langere verblijftijd, toont aan dat de dieren het medicijn beter lijken te verdragen wanneer dit toedieningssysteem wordt gebruikt”, zegt Mørch.
Er zijn ook andere voordelen.
“De grootte van de nanodeeltjes betekent dat ze een groot oppervlak hebben in verhouding tot hun volume”, zegt hij. “In elke milliliter oplossing zitten maar liefst 10¹² deeltjes – letterlijk miljarden deeltjes. Dit maakt een enorm oppervlak beschikbaar voor interactie tussen de deeltjes en hun omgeving, en niet in de laatste plaats voor hechting aan de verschillende cellen en weefsels in het menselijk lichaam ‘, zegt Morch.
Hierdoor kunnen de nanodeeltjes grote hoeveelheden van het medicijn aan de tumoren afleveren.
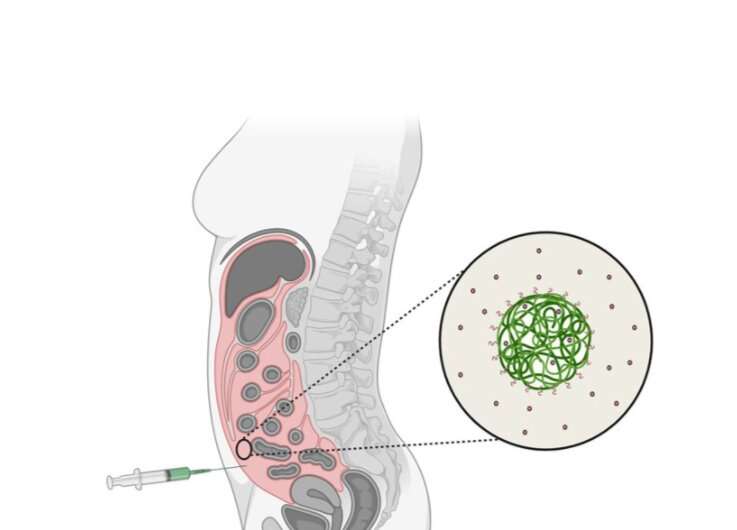
Diagram met het antikankercytotoxine cabazitaxel (in rood) ingekapseld in dragers van nanodeeltjes. Het materiaal dat is gebruikt om de capsule te maken (in het groen) is een afbreekbaar synthetisch polymeer. Hetzelfde materiaal wordt gebruikt om wonden te sluiten, omdat het in het lichaam geleidelijk zal worden afgebroken. Krediet: SINTEF/NaDeNo
Een effectief cytotoxine tegen kanker
Het product dat momenteel door NaDeNo wordt ontwikkeld, kan dus worden omschreven als een nanotechnologisch platform voor het inkapselen van niet-wateroplosbare (hydrofobe) geneesmiddelen in dragers van nanodeeltjes. Er is momenteel een grote vraag naar de effectieve toediening van dergelijke medicijnen.
“Als we slagen met ons eerste product, stelt het ons in staat een leveringstechnologie aan te bieden waarvan bedrijven in zowel de farmaceutische als de biotechnologiesector kunnen profiteren”, zegt Mørch.
Het cytotoxine dat het bedrijf gebruikt, heet cabazitaxel. Het is zeer effectief, maar de huidige toedieningswijzen zorgen ook voor grote bijwerkingen.
“Cabazitaxel wordt momenteel alleen gebruikt voor de behandeling van prostaatkanker”, zegt Annbjørg Falck. “De actieve component is zeer giftig en slecht oplosbaar in water. Om deze reden zijn er grenzen aan hoeveel van het medicijn kan worden toegediend zonder ernstige bijwerkingen te veroorzaken”, zegt ze.
De slechte oplosbaarheid in water van cabazitaxel maakt het moeilijk om systemen voor het afleveren van nanodeeltjes voor het medicijn te ontwikkelen. NaDeNo moet dus aantonen dat het inbedden van het medicijn in nanodeeltjes een betere werkzaamheid biedt in vergelijking met de huidige behandelingen voor patiënten met uitzaaiingen van kanker naar de buikholte.
“Cabazitaxel is zeer krachtig en vertoont minder resistentieontwikkeling dan andere vergelijkbare cytotoxinen”, zegt Falck. “Een nieuwe en geoptimaliseerde toedieningsmethode zal dus veel meer patiënten in staat stellen te profiteren van dit effectieve medicijn”, zegt ze.
Meerdere toepassingen
Tot nu toe werd SINTEF’s ontwikkeling van zijn nanodeeltjestechnologie uitgevoerd in nauwe samenwerking met het Noorse Radiumziekenhuis in Oslo, met expertise op het gebied van peritoneale kankerbehandelingen.
Deze samenwerking heeft NaDeNo’s eerste ontwikkelingskandidaat een belangrijke klinische basis gegeven en het bedrijf in staat gesteld toegang te krijgen tot representatieve muismodellen van menselijke kankers, met veelbelovende resultaten.
“Het Radium Hospital behandelt patiënten met uitzaaiingen naar de peritoneale holte volgens hoge internationale normen”, zegt Mørch. “De methode heet hyperthermische intraperitoneale chemotherapie (HIPEC), waarbij al het zichtbare tumorweefsel chirurgisch uit de holte wordt verwijderd voorafgaand aan lokale behandeling met verwarmde chemotherapie. In sommige gevallen wordt met deze methode een betere werkzaamheid bereikt. De behandeling is echter zeer inspannend voor de patiënten die erg ziek zijn Het cytotoxine heeft een korte verblijftijd in het peritoneum en verspreidt zich snel naar andere delen van het lichaam.
Kjersti Flatmark is Professor en Senior Consultant gastrochirurgie in het Noorse Radium Ziekenhuis en spreekt zeer positief over de samenwerking met NaDeNo en SINTEF.
“Uitzaaiingen naar het peritoneum zijn moeilijk te behandelen en hebben een zeer slechte prognose. Helaas genezen onze huidige behandelingsmethoden onze patiënten zelden, dus er is duidelijk behoefte aan betere behandelingsopties. Het was opwindend om deel uit te maken van dit samenwerkingsverband inspanning, eerst met SINTEF en nu met NaDeNo. Tot nu toe hebben we ons gericht op de ontwikkeling en het testen van de technologie in modelsystemen, en we hopen dat op de lange termijn de afgifte van cytotoxinen in dragers van nanodeeltjes zal bijdragen aan een betere behandelingseffectiviteit , waardoor veel meer patiënten kunnen genieten van een volledig herstel’, zegt ze.
In eerste instantie richt NaDeNo zich op een groep van 37.000 patiënten per jaar in Europa en de VS. Ook heeft het bedrijf ambities om de technologie toe te passen op een groter aantal patiënten.
“Als het eerste medicijnafgiftesysteem werkt, zal dit een goede indicatie zijn dat we een technologie hebben die kan worden gebruikt voor de behandeling van vele soorten kanker die momenteel moeilijk te behandelen zijn”, zegt Mørch.
In augustus 2022 werd de eerste ontwikkelingskandidaat van NaDeNo door de NCI geaccepteerd als een veelbelovend nanogeneesmiddel. Het NCI voert gratis een gestandaardiseerd preklinisch testprogramma uit, met als doel de ontwikkeling van nanogeneesmiddelen te versnellen die het potentieel hebben om patiënten met levensbedreigende ziekten te behandelen waarvoor momenteel een dringende medische vraag is om een remedie te vinden.
“Opname in een van de preklinische testprogramma’s van de NCI is een belangrijke mijlpaal voor ons en biedt een waardevolle erkenning van ons ontwikkelingsprogramma”, zegt Annbjørg Falck. De criteria voor opname zijn vrij streng, dus dit toont aan dat het werk dat SINTEF gedurende vele jaren heeft uitgevoerd van een hoog internationaal niveau is”, zegt ze.
Heidi Johnsen is onderzoeksmanager voor het team van SINTEF dat heeft deelgenomen aan de ontwikkeling van het NaDeNo-technologieplatform en is optimistisch over de toekomst van het spin-offbedrijf.
“Bij SINTEF werken we aan het ontwikkelen van technologie voor een betere samenleving en ik ben trots op wat we tot nu toe hebben bereikt. We zullen ons best blijven doen op het gebied van effectieve samenwerking om ervoor te zorgen dat NaDeNo succesvol is met zijn productontwikkeling,” ze zegt.
“Onze huidige strategie is om solide toekomstige investeringen veilig te stellen met als doel ons eerste product op de markt en bij patiënten te brengen, terwijl we tegelijkertijd ons technologisch platform blijven ontwikkelen”, zegt Falck. “In dit verband willen we ook de banden smeden met partners in de biotechnologie- en farmaceutische sector die op zoek zijn naar nieuwe en betere manieren om slecht in water oplosbare medicijnen af te leveren”, besluit ze.
Aangeboden door de Noorse Universiteit voor Wetenschap en Technologie