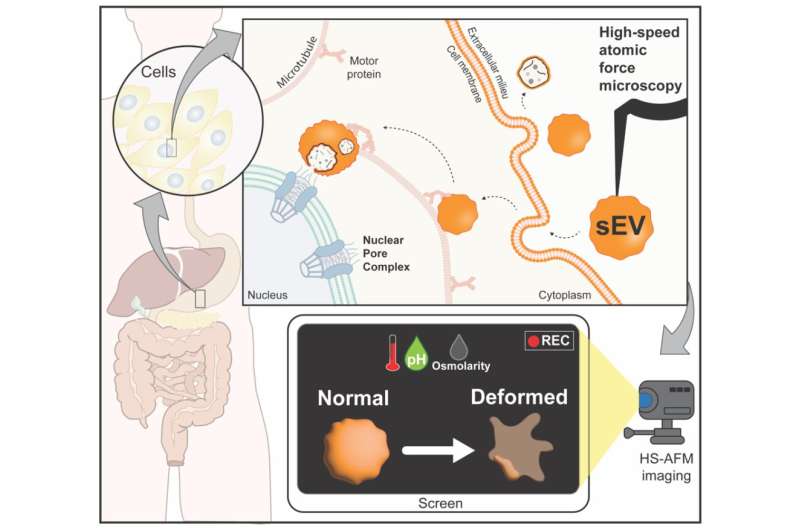
Structurele veranderingen van kleine extracellulaire blaasjes (sEV) als reactie op fysisch-chemische stress. sEV uitgescheiden voor cel-tot-cel communicatie, bijvoorbeeld het sturen van biomoleculen naar het nucleair poriecomplex (NPC). HS-AFM als nanoimaging-tool toont veranderingen in de structuur van sEV’s bij variërende temperaturen, pH en osmotische druk. Krediet: Elma Sajidah
In een recent gepubliceerde studie in de Journal of extracellulaire blaasjesonderzoekers van Kanazawa University gebruiken hogesnelheidsmicroscopie om de dynamiek vast te leggen van zakjes van nanoformaat die uit cellen worden vrijgegeven.
Kleine extracellulaire blaasjes (sEV’s) zijn kleine zakjes die door cellen worden vrijgegeven om chemische boodschappers naar andere cellen te brengen. Omdat sEV’s compatibel zijn met biologisch weefsel, worden ze onderzocht als dragers voor nanodrugs. De impact van fysiologische stress, zoals veranderingen in temperatuur, op de structuur van sEV’s is echter onduidelijk. Een onderzoeksteam onder leiding van Richard Wong en Keesiang Lim aan de Kanazawa University heeft nu een geavanceerde vorm van microscopie gebruikt om deze veranderingen in realtime op te helderen.
De temperatuur, het zuur- en zoutgehalte in ons lichaam kunnen fluctueren door factoren als ziekte. Onderzoek naar sEV’s voor de ontwikkeling van geneesmiddelen vereist dus een beter begrip van hoe stressvolle omgevingen de structuur van de blaasjes beïnvloeden. Voor hun studie isoleerde het team eerst sEV’s uit cellen. Vervolgens werd met behulp van een techniek die bekend staat als high-speed atomic force microscopy (HS-AFM) onthuld dat de structuur van sEV’s bolvormig of ellipsvormig van vorm is. HS-AFM stelde de onderzoekers ook in staat om de grootte van sEV’s nauwkeurig te meten zonder de vesiculaire membranen te scheuren of te beschadigen.
Het effect van variërende temperaturen op sEV’s was de eerste parameter die werd beoordeeld. Bij temperaturen hoger dan de normale lichaamstemperatuur (37°C) vertoonden de blaasjes vervormingen in vorm gekoppeld aan een verlies aan elasticiteit van hun membranen. Aan de andere kant hadden sEV’s in koude omstandigheden (4°C) een verminderd vermogen om intern materiaal effectief vrij te geven.
De onderzoekers bestudeerden vervolgens de effecten van pH (zuurwaarden) op sEV’s. De fysiologische pH van de bloedbaan is 7,4. Een pH van minder dan 7 duidt op zure omstandigheden en alles daarboven wordt alkalisch genoemd. De sEV’s leken hun vorm te behouden in zure omstandigheden (pH 4) maar in alkalische omstandigheden (pH 10) waren ze vervormd. Bij een pH van 4 waren de sEV’s echter kleiner, wat suggereert dat hun interne inhoud verloren was gegaan.
Nu zijn zoutniveaus (bekend als osmotische druk) bij een concentratie van 0,15 M gezond. Veranderingen in osmotische druk kunnen echter nadelige effecten hebben op cellen. Naarmate de omstandigheden geleidelijk veranderden, bleek dat de sferische aard van sEV’s afnam bij hoge zoutconcentraties (1,8 M), maar intact leek te blijven bij lage concentraties (0 M). Na een tijdje vertoonden blaasjes in hoge osmotische omstandigheden gescheurde membranen.
Een goed begrip van deze dynamiek is absoluut noodzakelijk om sEV’s te formuleren als farmaceutische hulpmiddelen bij verschillende ziektetoestanden. Deze studie heeft HS-AFM vastgesteld als een nuttig hulpmiddel om veranderingen in sEV’s onder verschillende fysiologische omstandigheden in realtime weer te geven. “Samenvattend toont ons onderzoek de haalbaarheid aan van HS-AFM voor structurele karakterisering en beoordeling van nanodeeltjes”, concludeert het team.
Kleine extracellulaire blaasjes (sEV’s) zijn zakjes die chemicaliën bevatten zoals eiwitten, DNA of metabolieten die door cellen worden afgegeven. Gewoonlijk spelen ze de rol van boodschappers, sEV’s leveren deze chemicaliën vervolgens af aan naburige of verre cellen. Daarom zijn hun vorm, grootte en elasticiteit belangrijk voor een goede werking van sEV’s. sEV’s met verminderde membraanelasticiteit zijn bijvoorbeeld mogelijk niet in staat om hun inhoud effectief af te geven.
sEV’s zijn doorgaans kleiner dan 200 nm en vervoeren zeer kleine moleculen. Ze worden daarom onderzocht op hun mogelijke rol bij het afleveren van geneesmiddelen/vaccins op nanoschaal of chemicaliën die voor diagnose worden gebruikt. De fysieke eigenschappen van sEV’s onder variërende fysiologische stress zijn dus belangrijk voor het begrijpen van hun gedrag in verschillende weefsels en ziektetoestanden.
Traditionele AFM is een vorm van microscopie die gebruik maakt van een puntige hefboom die over het oppervlak van moleculen graast om hun topografie weer te geven. Terwijl de hendel beweegt, zendt hij signalen uit die helpen een beeld te creëren van de structuur van het molecuul. De snelheid waarmee signalen worden uitgezonden in AFM is echter te laag om dynamische veranderingen vast te leggen. HS-AFM daarentegen maakt een snellere scan van moleculen mogelijk, zodat beelden in realtime kunnen worden verkregen. Zelfs kleine veranderingen in de structuur van een molecuul kunnen nauwkeurig worden vastgelegd.
Meer informatie:
Elma Sakinatus Sajidah et al, Spatiotemporeel volgen van nanotopologie van kleine extracellulaire blaasjes als reactie op fysisch-chemische spanningen onthuld door HS-AFM, Journal of extracellulaire blaasjes (2022). DOI: 10.1002/jev2.12275
Aangeboden door de Kanazawa-universiteit