Onderzoekers kunnen nu DNA veranderen in een voorheen ontoegankelijke organel
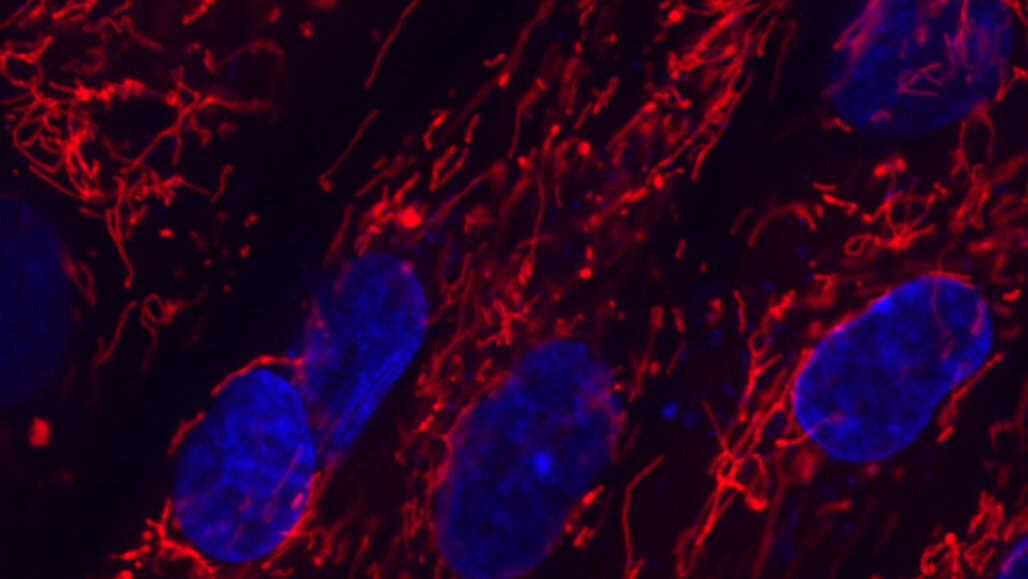
Wetenschappers rapporteren een nieuwe tool voor het bewerken van genen die zich kan richten op DNA in mitochondriën (rood). Eerdere editors waren alleen effectief in kernen (blauw).
Bacteriële wapens hebben een onverwacht gebruik in menselijke cellen.
Een eiwit dat door bacteriën wordt uitgescheiden om andere microben te doden, is dat wel geweest opnieuw ontworpen om DNA aan te passen ontoegankelijk voor andere gen-editors, rapporteren wetenschappers online op 8 juli in Natuur. De opmars maakt de weg vrij voor het op een dag herstellen van mutaties in mitochondriën. Die energieproducerende organellen worden geërfd van een moeder en hebben hun eigen DNA, verschillend van de genetische informatie – van beide ouders – die is opgeslagen in de celkern.
“Ik ben 25 jaar mitochondriaal bioloog geweest en beschouw dit als een uiterst belangrijke vooruitgang voor het veld”, zegt Vamsi Mootha, onderzoeker van het Howard Hughes Medical Institute in het Massachusetts General Hospital in Boston en het Broad Institute of MIT en Harvard .
Mutaties in mitochondriaal DNA veroorzaken meer dan 150 verschillende syndromen en treft jaarlijks 1.000 tot 4.000 kinderen die in de Verenigde Staten zijn geboren. Er zijn geen genezingen voor deze ziekten en momenteel is de enige manier om te voorkomen dat een kind disfunctionele mitochondriën erven een controversiële ‘drieouderbaby’-methode (SN: 14-12-16). Deze in-vitrofertilisatie-techniek vereist mitochondriën van een donorei, naast genetische informatie van moeder en vader.
Een benadering voor het ontwikkelen van behandelingen voor genetische ziekten is genbewerking, een techniek die rechtstreeks wijzigingen aanbrengt in DNA. Misschien wel de meest bekende gen-editor, CRISPR / Cas9 is een moleculaire schaar die DNA snijdt. Onderzoekers hebben eerder ook moleculen gebruikt, TALEN’s genaamd, om mitochondriaal DNA in muizen te versnijden en defecte organellen te elimineren (SN: 23-4-15). Een nieuwere technologie, genaamd base-editors, bindt eiwitten die DNA-basen – weergegeven door de letters A, C, G en T – kunnen veranderen in een gemodificeerde versie van het CRISPR-geassocieerde eiwit Cas9 (SN: 25-10-17). Deze editors transformeren de ene DNA-basis chemisch in een andere, waardoor in wezen typefouten worden hersteld die tot ziekte kunnen leiden. Deze technologie werkt echter alleen op DNA in kernen, niet op mitochondriën.
Het gif dat door de bacteriën wordt uitgescheiden Burkholderia cenocepacia bleek onverwacht de oplossing die nodig was om een mitochondriënvriendelijke basiseditor te maken. Marcos de Moraes, een microbioloog aan de Universiteit van Washington in Seattle, concludeerde dat het toxine bacteriën doodde door storende DNA-mutaties te veroorzaken. Maar maandenlang kon hij niet ontwarren hoe het proces op moleculair niveau werkte. Hij stond op het punt om verder te gaan met het project toen een enkel nachtelijk experiment alles op zijn plaats liet vallen.
Het was als een soap, zegt De Moraes. Hij had al vroeg vermoed dat het toxine-eiwit zich aan DNA hechtte en één DNA-letter, cytosine (C), veranderde, dus het leek op een andere, thymine (T). Deze opzettelijke DNA-typefouten brachten de slachtoffers van het gif naar beneden. Maar wat de Moraes van dat noodlottige nachtelijke experiment leerde, was dat, in tegenstelling tot alle andere cytosine-converterende eiwitten, het toxine veranderingen aanbracht in dubbelstrengs DNA in plaats van enkelstrengs DNA.
Dit lijkt een klein verschil, maar heeft grote gevolgen. Tot nu toe hebben basiseditors eiwitten zoals Cas9 gebruikt om doel-DNA uit elkaar te halen in afzonderlijke strengen voordat ze een wijziging aanbrachten. Maar stukjes RNA die nodig zijn voor de functie van deze eiwitten, kunnen niet in de mitochondriën terechtkomen. Een basiseditor gebaseerd op de B. cenocepacia toxine, dat werkt op dubbelstrengs DNA, hoeft niet langer afhankelijk te zijn van Cas9.
Het vooruitzicht om een mitochondrievriendelijke tool te ontwikkelen, leidde tot gesprekken met David Liu, een chemisch bioloog en HHMI-onderzoeker aan de Harvard University en het Broad Institute of MIT en Harvard.
Het nieuwe cytosine-converterende enzym was echter net zo dodelijk voor zoogdiercellen als voor bacteriële prooien. De eerste stap bij het ’temmen van het beest’ was het aanpassen van het toxine, zodat het niet zomaar dubbelstrengs DNA verprutste, zegt Liu. De onderzoekers splitsten het eiwit in niet-toxische helften; de twee delen veranderden alleen cytosine in thymine wanneer ze op dezelfde plek van DNA werden samengebracht.
‘Het is best briljant’, zegt Carlos Moraes, een mitochondriale bioloog aan de Universiteit van Miami in Florida, die niet bij het werk betrokken was.
Om de activiteit van de enzymhelften te sturen, bevestigden de onderzoekers TALE-eiwitten, korte stukjes eiwit die konden worden gekozen om specifieke stukjes DNA te targeten. In celkweekexperimenten heeft de mitochondriale editor met succes cytosine omgezet in thymine op bedoelde mitochondriale DNA-locaties, met een efficiëntie variërend van 5 tot 49 procent.
Toekomstig werk zal gericht zijn op het verbeteren van de efficiëntie, het ontwikkelen van nieuwe soorten mitochondriale editors die andere DNA-basisveranderingen kunnen produceren, en kijken of mitochondriale genbewerking bij dieren werkt.
‘Dit is slechts de eerste stap’, zegt Shoukhrat Mitalipov, een mitochondriale bioloog aan de Oregon Health & Science University in Portland, die niet bij het werk betrokken was. ‘Maar in de goede richting.’