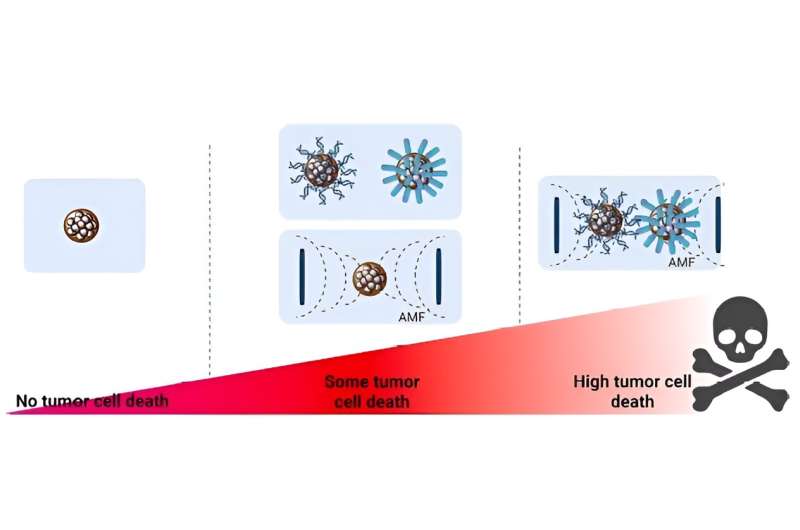
De combinatie van magnetische veldnanodeeltjes en chemotherapiemedicijnen bereikt een grotere werkzaamheid tegen kankercellen. Credit: Tijdschrift voor colloïd- en interfacewetenschap (2024). DOI: 10.1016/j.jcis.2024.05.046
Het pad naar een genezing voor kanker is niet uniek, aangezien de ziekte een extreem complex proces is. Meerdere factoren zijn betrokken bij het proces van het effectief elimineren van een tumor en daarom is het hebben van verschillende strategieën tegen kanker in dit opzicht essentieel.
In een recente studie stellen onderzoekers van het instituut “IMDEA Nanociencia” het gebruik voor van multicore magnetische nanodeeltjes, een nieuw type waarvoor nauwelijks studies zijn uitgevoerd naar hun werkzaamheid tegen kanker in fysiologische omgevingen. Hun studie analyseert specifiek de effecten van multinucleus nanodeeltjes op verschillende kankercellijnen.
Multicore nanodeeltjes zijn aggregaten van kleinere nanodeeltjes. De selectie van deze multicore nanodeeltjes is gebaseerd op het feit dat ze tot de meest verhitte behoren in magnetische hyperthermieprocessen.
Bij een proces van magnetische hyperthermie wordt het magnetische materiaal, in dit geval de nanodeeltjes, blootgesteld aan een wisselend magnetisch veld dat de temperatuur op een gecontroleerde manier verhoogt. Als deze deeltjes in de omgeving van een tumor worden aangetroffen, zouden ze de cellen van de tumor bijvoorbeeld boven hun kritische temperatuur verhitten, wat de dood van de kankercellen en deactivering van de tumor veroorzaakt.
Momenteel wordt magnetische hyperthermie in klinische proeven in een paar ziekenhuizen over de hele wereld aangetroffen. Daarom is onderzoek essentieel zodat alternatieve behandelingen patiënten kunnen bereiken en bij alle soorten tumoren kunnen worden gebruikt.
In hun werk hebben onderzoekers de werkzaamheid van twee verschillende nanodeeltjesmorfologieën bestudeerd bij het verminderen van de levensvatbaarheid van kankercellijnen. Verder hebben ze twee soorten antikankermoleculen aan het oppervlak van de nanodeeltjes toegevoegd om het effect te versterken: een chemotherapiemedicijn en microRNA’s. MicroRNA’s zijn kleine moleculen van ribonucleïnezuur (RNA), die in dit geval fungeren als tumorsuppressoren.
De gemodificeerde nanodeeltjes zijn geïnternaliseerd door commerciële cellijnen van verschillende soorten kanker: pancreas-, uvea-, long-, colon- en borstkanker. Het gebruik van deze cellijnen geeft wetenschappers overal ter wereld de mogelijkheid om de resultaten van verschillende experimenten op dezelfde cellen te vergelijken, onder reproduceerbare omstandigheden.
De studie van de levensvatbaarheid van tumorcellen is zeer uitputtend en alle mogelijke combinaties zijn vergeleken: ongemodificeerde nanodeeltjes; gemodificeerd door het toevoegen van een chemotherapiemedicijn, of door het toevoegen van microRNA’s; of beide. En alle bovenstaande mogelijkheden zijn bestudeerd onder invloed van hyperthermische verwarming.
De resultaten lieten zien dat de combinatie van de drie therapieën, antikankermedicijnen, genregulatie door microRNA’s en magnetische hyperthermie, de beste resultaten opleverde. De levensvatbaarheid van cellen wordt over het algemeen meer aangetast wanneer de effecten van de twee therapieën worden samengevoegd. De studie, onlangs gepubliceerd in de Tijdschrift voor colloïd- en interfacewetenschaponthult alle details van dit uitgebreide werk.
De binding van antikankermoleculen aan magnetische nanodeeltjes is zeer relevant. De antikankerwerking van de moleculen zelf wordt vooral versterkt door verhitting door magnetische hyperthermie.
Daarnaast dienen nanodeeltjes als een vehikel om microRNA’s af te leveren waar ze handig zijn, omdat ze niet oplosbaar zijn in water en een transportmiddel naar de cel nodig hebben. De afgifte van medicijnen die gekoppeld zijn aan nanodeeltjes verloopt langzamer, omdat hun halfwaardetijd langer is, en er dus meer controle is over het proces. De dosis die aan de patiënt wordt toegediend, zou ook worden verlaagd, waardoor bijwerkingen na chemotherapiebehandeling worden verminderd.
Bij een ziekte die zo complex is als kanker, zijn de oplossingen daarom ook complex. Er is geen enkele behandeling voor een volledige genezing, maar er is de mogelijkheid om voor elk type tumor en persoon een effectieve behandeling te bieden vanuit verschillende aspecten van gepersonaliseerde geneeskunde en nanomedicijnen.
Momenteel is de toepassing van nanodeeltjes tegen kanker niet wijdverbreid in de klinische praktijk om verschillende redenen. Intratumorale toediening van de nanodeeltjes is nodig, die na de behandeling in het lichaam blijven; en er zijn nog steeds geen studies naar het gedrag ervan op de lange termijn.
Positief is dat hyperthermiebehandeling met nanodeeltjes een methode van “fysieke actie” is, waarbij het moeilijker is om resistentie te genereren, zoals het geval is bij sommige chemotherapiebehandelingen, en die ook overdraagbaar is op andere soorten tumoren. Kankerbehandelingen op basis van gepersonaliseerde nanomedicijnen met behulp van nanodeeltjes zijn veelbelovend, omdat ze medicijnen of therapeutische warmte rechtstreeks in kankercellen afgeven, met een zeer nauwkeurig effect.
Meer informatie:
David García-Soriano et al, Multicore ijzeroxide nanodeeltjes voor magnetische hyperthermie en combinatietherapie tegen kankercellen, Tijdschrift voor colloïd- en interfacewetenschap (2024). DOI: 10.1016/j.jcis.2024.05.046
Geleverd door IMDEA Nanociencia