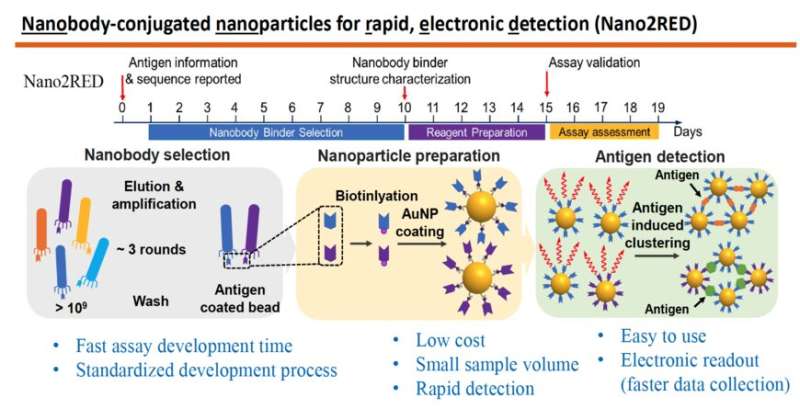
De afbeelding benadrukt de belangrijkste kenmerken van Nano2RED, een innovatieve diagnostische methode die is uitgevonden door professor Wang en zijn collega’s. Het bovenste gedeelte illustreert de snelle tijdlijn van stappen voor de productie van de test, die allemaal in ongeveer 20 dagen kunnen worden uitgevoerd. Het middelste gedeelte van de afbeelding toont de betrokken basisstappen. Eerst wordt een grote bibliotheek van synthetische antilichamen of nanobodies geproduceerd en gescreend tegen een bekend antigeen (links), vervolgens worden nanobodies gehecht aan gouden nanodeeltjes (midden) en ten slotte worden ziekteantigenen gedetecteerd in een monster wanneer gouden nanodeeltjesgebonden nanobodies samensmelten met hen, wat een positief testresultaat oplevert, (rechts). Krediet: Wang-lab
In de afgelopen jaren zijn dodelijke infectieziekten, waaronder ebola en COVID-19, naar voren gekomen om wijdverbreide menselijke verwoesting te veroorzaken. Hoewel onderzoekers een reeks geavanceerde methoden hebben ontwikkeld om dergelijke infecties op te sporen, heeft de bestaande diagnostiek te maken met veel beperkingen.
In een nieuwe studie beschrijft Chao Wang, een onderzoeker aan het Biodesign Institute en School of Electrical, Computer & Energy Engineering van de Arizona State University, samen met ASU-collega’s en medewerkers aan de University of Washington (UW), Seattle een nieuwe methode voor het detecteren van virussen zoals Ebola-virus (EBOV) en SARS CoV-2.
De techniek, bekend als Nano2RED, is een slimme variant op conventionele uiterst nauwkeurige tests die gebaseerd zijn op complexe testprotocollen en dure uitleessystemen. De nanosensoren in de oplossing (“Nano2” in de naam) dienen om ziekte-antigenen in een monster te detecteren door eenvoudig te mengen. Het innovatieve Rapid and Electronic Readout-proces (“RED”) dat in het Wang-lab is ontwikkeld, levert testresultaten, die detecteerbaar zijn als een kleurverandering in de monsteroplossing, en registreert de gegevens via goedkope halfgeleiderelementen zoals LED’s en fotodetectoren.
De technologie betekent een belangrijke vooruitgang in de strijd tegen infectieziekten. Het kan tegen zeer lage kosten worden ontwikkeld en geproduceerd, binnen weken of dagen na een uitbraak worden ingezet en beschikbaar worden gesteld voor ongeveer 1 cent per test.
Vergeleken met veelgebruikte, zeer nauwkeurige laboratoriumtests, zoals ELISA, is Nano2RED veel gemakkelijker te gebruiken. Het vereist geen oppervlakte-incubatie of wassen, kleurstoflabeling of amplificatie, maar biedt toch een ongeveer 10 keer betere gevoeligheid dan ELISA. Bovendien ondersteunt het gebruik van halfgeleiderapparatuur een zeer draagbaar digitaal uitleessysteem, dat kan worden ontwikkeld en geproduceerd tegen een prijs van slechts een paar dollar, waardoor het niet alleen ideaal is voor laboratoriumgebruik, maar ook voor klinieken, thuisgebruik en op afstand of locaties met beperkte middelen. Deze aanpak is gebaseerd op modulaire ontwerpen en kan mogelijk worden gebruikt om op elke ziekteverwekker te testen.
“Deze technologie werkt niet omdat ze complex is, maar omdat ze eenvoudig is”, zegt professor Wang. “Een ander uniek kenmerk is de multidisciplinaire aard van biosensing. Een fundamenteel begrip van biochemie, fluïdica en opto-elektronica heeft ons geholpen om iets te bedenken dat zo ‘simpel’ is.”
Wang is onderzoeker bij het Biodesign Center for Molecular Design and Biomimetics aan de ASU. Hij is ook een onderzoeker bij ASU’s School of Electrical, Computer and Energy Engineering; en het Centrum voor Fotonische Innovatie. Dr. Liangcai Gu is de medewerker bij de afdeling Biochemie en het Instituut voor Eiwitontwerp bij UW, Seattle.
Het onderzoek verschijnt in het huidige nummer van het tijdschrift Biosensoren en bio-elektronica. Dr. Xiahui Chen en Md Ashif Ikbal van ASU en Dr. Shoukai Kang van UW zijn de eerste auteurs, en Jiawei Zuo en Yuxin Pan zijn de andere bijdragende auteurs.
Het testende knelpunt
Epidemiologen kennen de basisformule al lang als ze worden geconfronteerd met een ziekte-uitbraak. Om gevallen te identificeren en de besmetting te stoppen, is het noodzakelijk om een nauwkeurige test of test te ontwikkelen die de ziekte kan identificeren, en vervolgens vroeg en vaak te testen om de verspreidingssnelheid te beoordelen en te proberen de geïnfecteerde te isoleren.
Helaas is de uitbraak van de ziekte vaak al wijdverbreid en moeilijk te beheersen tegen de tijd dat een nieuwe diagnose is ontwikkeld, vervaardigd en verspreid. Verder zijn nauwkeurige tests, waaronder PCR (die minuscule niveaus van pathogene nucleïnezuren kunnen versterken tot meetbare niveaus), vaak duur, arbeidsintensief en vereisen geavanceerde laboratoriumfaciliteiten.
De ebola-epidemie van 2014-2016, hoewel grotendeels beperkt tot West-Afrika, verspreidde zich met angstaanjagende snelheid, veroorzaakte paniek en doodde meer dan 11.000 mensen. De dodelijkheid van het virus, een van de hoogste voor alle bekende ziekteverwekkers, kan meer dan 90% bedragen, afhankelijk van de ziektestam. De crisis werd verergerd door een combinatie van ontoereikende bewakingssystemen en een slechte infrastructuur voor de volksgezondheid.
SARS CoV-2, hoewel minder dodelijk dan ebola, heeft zich naar elk land op aarde verspreid en heeft wereldwijd al meer dan 5,6 miljoen mensen gedood. Bij beide ziekte-uitbraken kwamen diagnostische tests laat ter plaatse. Verder hebben dure en omslachtige testvereisten ertoe geleid dat er veel te weinig tests zijn uitgevoerd, zelfs na hun succesvolle ontwikkeling.
De nieuwe studie past zijn innovatieve methode toe om op deze twee prominente ziekten te testen als een proof of concept.
Vloedgolf
Een gemeenschappelijk kenmerk van veel ziekte-uitbraken is de bliksemsnelheid waarmee een ziekteverwekker, nadat hij eerst een handvol mensen heeft besmet, momentum kan krijgen, alle kanten op kan uitwaaieren en ziekenhuizen en zorgverleners snel kan overweldigen. Het afsnijden van de transmissieroutes van een ziekteverwekker vereist het zo snel mogelijk identificeren en isoleren van zieke personen door middel van testen.
Tijdens een pandemie als COVID-19 is de gevoeligheid van een bepaalde diagnostische test ondergeschikt aan hoe vaak de test wordt gegeven en hoe lang het duurt voordat de resultaten zijn verwerkt. Een zeer gevoelige test is van beperkt nut als deze maar één keer kan worden gegeven, en de resultaten vereisen een doorlooptijd van weken. Onderzoek heeft aangetoond dat uitbraken van infecties het best onder controle kunnen worden gehouden wanneer het testen wordt herhaald met tussenpozen van minder dan 3 dagen en op grote schaal.
Om de samenleving goed voor te bereiden op huidige en toekomstige uitbraken van infectieziekten, is snellere, goedkopere, nauwkeurigere en beter bruikbare diagnostiek nodig.
Sluit affiniteit
De nieuwe technologie kan uitgescheiden glycoproteïne (sGP), een veelbetekenende vingerafdruk van de Ebola-virusziekte en het SARS-CoV-2 spike-eiwitreceptorbindingsdomein (RBD) identificeren. De technologie is zeer nauwkeurig en wedijvert met ELISA, een lang erkende gouden standaardtechnologie voor diagnostische tests.
Het basisidee van dergelijke diagnostiek, bekend als immunoassays, is eenvoudig: een bloedmonster (of een andere biologische vloeistof) wordt op de test aangebracht, die is versierd met antilichamen. Wanneer antilichamen de aanwezigheid van een overeenkomstig ziekteantigeen in het monster herkennen, binden ze zich eraan, wat een positief testresultaat oplevert. Bij de ELISA-test moet het ziekteantigeen op een vlakke ondergrond worden geïmmobiliseerd.
Nano2RED vertrouwt ook op bindingsaffiniteit voor positieve diagnose, maar gebruikt in plaats daarvan zwevende gouden nanodeeltjes voor uitlezing. In tegenstelling tot ELISA kan Nano2RED in ongeveer 10 dagen helemaal opnieuw worden ontwikkeld en is het in theorie toepasbaar voor elke ziekteverwekker, waardoor vroegtijdige bewaking van essentieel belang is in het geval van een ziekte-uitbraak. Het kan testresultaten opleveren in 15-20 minuten en kan worden toegediend tegen een geschatte kostprijs van een cent per test. In de huidige studie bleek de nieuwe test Ebola’s sGP in serum te detecteren met een gevoeligheid die ongeveer 10 keer beter is dan ELISA.
Gevaar voelen
Bij deze methode is de eerste stap het produceren van een zeer grote bibliotheek met meer dan een miljard willekeurige aminozuursequenties, bekend als nanobodies, die kunnen werken als synthetische antilichamen die in staat zijn om te binden met ziekteantigenen die het doelwit zijn. Deze enorme bibliotheek van nanobodies wordt vervolgens achtereenvolgens gescreend tegen het betreffende antigeen, bijvoorbeeld sGP in het geval van ebola. Alleen die nanobodies die een sterke bindingsaffiniteit voor het antigeen vertonen, worden gebruikt voor detectie.
Vervolgens worden de geselecteerde nanobodies aangebracht op gouden nanodeeltjes die zullen fungeren als sondes om antigenen die aanwezig zijn in een bloedmonster te identificeren en eraan te binden. In de studie werd een paar van twee nanobodies met hoge affiniteit geselecteerd en bevestigd aan gouden nanodeeltjes. Deze aanpak verbetert zowel de gevoeligheid als de specificiteit van de test.
De belangrijkste innovatie van Nano2RED is de manier waarop de antigeendetectie wordt geregistreerd. Omdat ziekte-antigenen in het monster worden herkend door de nanobodies, binden ze zich aan elkaar en vormen clusters van gebonden nanobody en antigeen, zoals eilanden van algen die op het zeeoppervlak drijven. “Kortom, een antigeen werkt als superlijm om het nanodeeltje bij elkaar te brengen”, zegt Wang.
Een ‘gouden’ kans in de strijd tegen infectieziekten
De gouden nanodeeltjes bieden een stabiel platform om de nanobodies op hun plaats te houden. Zodra er voldoende binding heeft plaatsgevonden, beginnen de gebonden clusters naar de bodem van het vat te zinken. Dit is met het blote oog waar te nemen in de vorm van een kleurverandering. De oplossing wordt lichter van kleur naarmate de door goud-nanodeeltjes gedragen antigeen-antilichaamclusters neerslaan, wat de detectie van de ziekteverwekker aangeeft.
Hoewel volledige precipitatie van nanodeeltjesclusters die tot een testresultaat leiden normaal gesproken enkele uren kan duren, kan het proces worden versneld door het monster te centrifugeren, waardoor de wachttijd voor precipitatie wordt geëlimineerd. In dit geval zijn slechts 15-20 minuten voldoende voor een resultaat. “Natuurlijk zijn de gouden nanodeeltjes zwaar, en dat helpt ook bij snelle sedimentatie.” voegde Wang toe.
Gouden nanodeeltjes werken ook om kleur weer te geven, niet geel maar rood, door licht uit een smal spectraal bereik te absorberen. Dankzij deze absorptiefunctie kon het Wang-lab een klein, goedkoop apparaat uitvinden dat deze kleurverandering omzet in een elektrisch signaal, met behulp van halfgeleider-LED’s en fotodetectoren die op kleur afstemmen. Dergelijke instrumenten produceren een snelle en nauwkeurige uitlezing van testresultaten, waarvan de detectielimieten vergelijkbaar zijn met of beter zijn dan dure laboratoriumgebaseerde spectroscopiemethoden.
De test levert ook kwantitatieve resultaten op basis van de hoeveelheid gedetecteerd antigeen. Dit kan van vitaal belang zijn voor het inschatten van de ernst van de ziekte en de tijd die is verstreken sinds de infectie. In de toekomst kunnen de testresultaten worden gedigitaliseerd door circuits en gemakkelijk via internet naar overal ter wereld worden verzonden voor gegevensanalyse en verder onderzoek, wat belangrijk kan zijn voor de besluitvormingsprocessen van het overheidsbeleid en het tijdig onderbreken van de transmissie.
Nano2RED vereist slechts een klein bloedmonster, meestal ongeveer 20 microliter. “Dit maakt goud in ons geval ook goedkoop, omdat de berg die we nodig hebben zo klein is”, zei Wang. In tegenstelling tot conventionele methoden is Nano2RED ook zeer eenvoudig te gebruiken met minimale training voor zorgpersoneel. Het vereist geen tijdrovende en dure incubatie, wassen, fluorescerende labeling of amplificatie.
Toekomstig onderzoek zal helpen de detectielimieten van de test nog verder te verbeteren en de detectiecapaciteiten te wijzigen om viriondeeltjes, extracellulaire blaasjes, kleine moleculen en nucleïnezuren te omvatten.
“Er is zeker nog veel te ontdekken,” voegde Wang eraan toe, “maar we hebben tot nu toe een gelukkig huwelijk tussen technische disciplines en biologie. En daar zullen we aan blijven werken.”
Xiahui Chen et al, Synthetische nanobody-gefunctionaliseerde nanodeeltjes voor versnelde ontwikkeling van snelle, toegankelijke detectie van virale antigenen, Biosensoren en bio-elektronica (2022). DOI: 10.1016/j.bios.2022.113971
Biosensoren en bio-elektronica
Geleverd door de Arizona State University