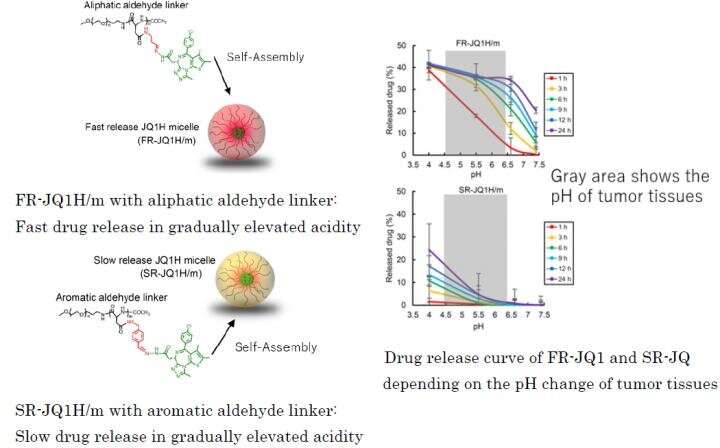
Fig.1: Verschillend geneesmiddelafgifteprofiel afhankelijk van de linker die wordt gebruikt voor blokcopolymeren van nanomicellen FR-JQ1H / m met alifatische aldehydelinker: snelle geneesmiddelafgifte in geleidelijk verhoogde zuurgraad SR-JQ1H / m met aromatische aldehydelinker: langzame geneesmiddelafgifte in geleidelijk verhoogde zuurgraad Geneesmiddelafgiftecurve van FR-JQ1 en SR-JQ afhankelijk van de pH-verandering van tumorweefsels Krediet: 2021 Innovatie. Centrum van NanoMedicine
Het innovatiecentrum van NanoMedicine rapporteerde in ACS Nano samen met de groep van Prof. Yu Matsumoto van Otorinolaryngology and Head and Neck Surgery en de groep van Prof. Horacio Cabral van de afdeling Bioengineering aan de Universiteit van Tokio dat de werkzaamheid van polymere nanomicellen met een verschillend geneesmiddelactiveringsprofiel afhangt van de expressieniveau van c-Myc, een van de belangrijkste proto-oncogenen, is ontwikkeld.
Het is bekend dat c-Myc betrokken is bij de proliferatie en angiogenese van kankercellen en de celcyclus verandert, normale celdifferentiatie onderdrukt en kankermetastase bevordert. Het is een typisch proto-oncogen dat veel genen reguleert die verband houden met groeifactoren en waarvan bekend is dat het betrokken is bij de ontwikkeling van veel kankers, zoals chromosomale translocatie bij Burkitt-lymfoom. Daarom wordt wereldwijd onderzoek gedaan naar het ontdekken van geneesmiddelen als een geneesmiddel tegen kanker dat zich richt op deze transcriptiefactor die kankerstamcellen direct kan aanvallen. Echter, aangezien embryonale letaliteit optreedt bij c-Myc knock-out muizen, wordt c-Myc beschouwd als een essentieel gen voor levende cellen, en selectieve afgifte aan kankerweefsels is een belangrijke sleutel voor de ontwikkeling van zijn remmers. Bovendien staat c-Myc ook bekend als een factor die nodig is voor de initiële inductie van iPS-cellen. Naar verwachting zal deze remming in de toekomst worden toegepast als een technologie die ook kan worden gebruikt om van iPS-cellen afgeleide carcinogenese te onderdrukken.
In deze studie werd JQ1H, een structureel analoog van JQ1H, een typische indirecte c-Myc-remmer, ingekapseld in functionele nanomicellen, en hun doeltreffendheid werd geëvalueerd. JQ1 bindt zich aan een broomdomein-eiwit BRD4, dat betrokken is bij de activering van RNA-polymerase II dat de expressie van c-Myc reguleert, om deze stroom sterk te remmen. Als gevolg hiervan wordt de activiteit van RNA-polymerase verzwakt en wordt de expressie van c-Myc neerwaarts gereguleerd. Hoewel JQ1 werd verwacht als een veelbelovend epigenoommedicijn vanwege de sterke remming van genexpressie, heeft het een extreem korte halfwaardetijd in vivo vanwege de snelle uitscheiding van de nieren en snelle klaring na toediening. Bovendien is JQ1 bijna onoplosbaar in water. Deze eigenschappen van JQ1 werden grote problemen om het als een effectief medicijn te ontwikkelen. De polymere nanomicellen die tot dusver in het Innovation Center of NanoMedicine (iCONM) zijn ontwikkeld voor antikankertherapie, toonden (1) stabilisatie van ingekapselde geneesmiddelen, (2) onderdrukking van nieruitscheiding, (3) EPR (selectieve medicijnafgifte aan kankerweefsels). ) gemedieerde tumoraccumulatie en (4) geneesmiddelafgifte op basis van tumoracidose. Deze keer hebben we een goede antitumoractiviteit bevestigd bij muizen die getransplanteerd waren met tongkanker, melanoom en alvleesklierkanker met behulp van met JQ1 uitgeruste nano-micellen.
-
bovenste: tongkanker, onderste: alvleesklierkanker. Krediet: 2021 Innovation Center of NanoMedicine
-
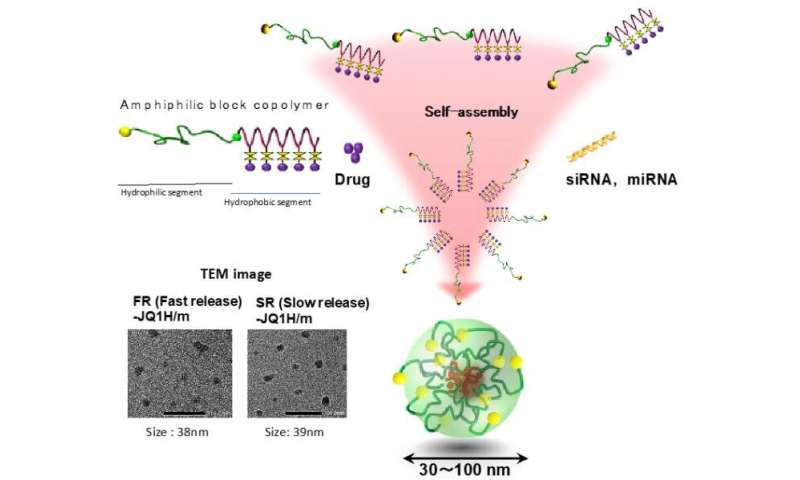
Polymere micellen waren een van de eerste zelfassemblages van polymeren die werden gerapporteerd als een nano-DDS, en zijn samengesteld uit twee verschillende domeinen, een kern die het geneesmiddel laadt en een hydrofiele schaal. Amfifiele blokcopolymeren, die een hydrofiel blok en een hydrofoob blok bevatten, blijken eerst die verschillende domeinen in een micelstructuur te construeren door spontane zelfassemblage als resultaat van hydrofobe interacties in waterig. H. Cabral, K. Miyata, K. Osada, K. Kataoka, “Blokcopolymeermicellen in nanogeneeskunde-toepassingen” Chem. Rev. 2018, 118 6844-6892. (DOI: 10.1021 / acs.chemrev.8b00199). Krediet: 2021 Innovation Center of NanoMedicine
Door het zogenaamde EPR-effect lekken nanomicellen met JQ1H uit de bloedvaten in het tumorweefsel na systemische toediening. Tumorweefsels zijn rijk aan melkzuur vanwege de verbeterde glycolyse en zijn zuurder dan normale weefsels. In dit werk werden twee soorten nanomicellen gemaakt; een waarin hydrofoob JQ1H werd gekoppeld aan een amfifiel blokpolymeer dat is samengesteld uit hydrofiel polyethyleenglycolblok en hydrofoob polyaminozuurblok met behulp van 3-aminopropionaldehyde (alifatisch aldehyde) linker en de andere micel waarin JQ1H werd gekoppeld aan polymeer via p-aminomethylbenzaldehyde ( aromatische aldehyde) linker. Een amfifiel blokpolymeer werd gesynthetiseerd en gebruikt als basismateriaal voor nanomicellen. Toen het zelf werd geassembleerd in water tot een micellaire structuur en toegediend aan kankerdragende muizen, werd antitumoractiviteit bereikt.
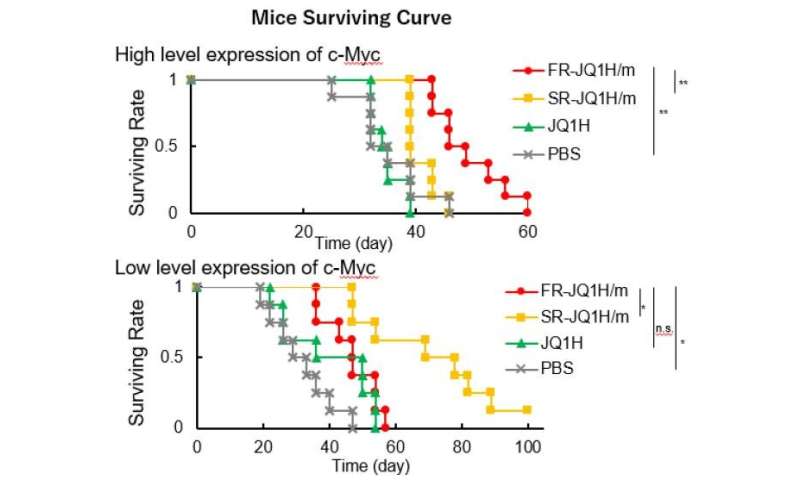
Wanneer de linker een alifatisch aldehyde is of wanneer het een aromatisch aldehyde is, verschilt het afgiftepatroon van het geneesmiddel sterk van de zuurgraad. De eerste geeft het medicijn snel af, en de laatste geeft het medicijn langzaam af. Daarom werd het voormalige nanomedicijn FR-JQ1H / m genoemd en het laatste SR-JQ1H / m. De antitumoractiviteit van deze nanomicellen verschilt sterk afhankelijk van het expressieniveau van c-Myc. Terwijl FR-JQ1H / m effectiever is voor tumoren met hoge c-Myc-expressie, is SR-JQ1H / m effectiever voor tumoren met lage c-Myc-expressie.
We geloven dat de selectie van nanomicellen op basis van het expressieniveau van biomarkers in de toekomst een belangrijke stap zal zijn in de richting van de realisatie van gepersonaliseerde geneeskunde en in-body ziekenhuizen.
Hitoshi Shibasaki et al, Werkzaamheid van pH-gevoelige nanomedicijnen in tumoren met verschillende c-MYC-expressie hangt af van het intratumorale activeringsprofiel, ACS Nano (2021). DOI: 10.1021 / acsnano.1c00364
ACS Nano
Geleverd door Innovation Center of NanoMedicine