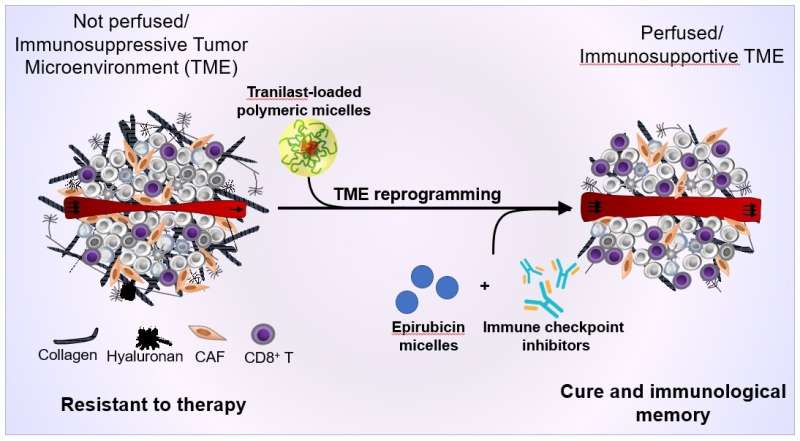
Polymere, tranilast-geladen micellen herprogrammeren effectief de tumormicro-omgeving in borsttumoren bij muizen om de perfusie te herstellen en zo de medicijnafgifte en de infiltratie van immuuncellen in de tumor te verbeteren. Dientengevolge versterken de polymere micellen de antikankertherapie met epirubicine-micellen en immunotherapie, wat leidt tot genezing en immunologisch geheugen. (Afbeelding aangepast van Panagi M et al., 2022, doi: 10.7150/thno.72800). Krediet: Horacio Cabral
Een groep onder leiding van prof. Horacio Cabral (Visiting Scientist van iCONM/Associate Professor of Bioengineering, Graduate School of Engineering, University of Tokyo) heeft een nieuwe aanpak ontdekt voor de behandeling van triple-negatieve borstkanker.
Het werk is gedaan in samenwerking met prof. Triantafyllos Stylianopoulos (assistent-professor, Universiteit van Cyprus), National Cancer Center of Japan en iCONM en gepubliceerd in Natuurcommunicatie.
Vuurvaste kankers, zoals triple-negatieve borstkanker of alvleesklierkanker, ontwikkelen een vezelachtig weefsel genaamd stroma, dat lijkt op een buitenaards ruimtevaartuig dat wordt beschermd met een energieschild en bestand is tegen aanvallen van buitenaf, zoals immuuncellen en geneesmiddelen tegen kanker. Het doel van deze studie was om CAF’s (kanker-geassocieerde fibroblasten) geactiveerd door oncogenese te hermodelleren en de rol van stroma, dat als kankerschild fungeert, te verzwakken, zodat ze kunnen reageren op immunotherapie en chemotherapie.
In deze studie concentreerden onderzoekers zich op een al lang vermeld anti-allergisch medicijn “Tranilast” en onderzochten ze de mate waarin het het stroma kan verzwakken wanneer het in polymere nanomicellen in het inwendige van de tumor wordt afgeleverd.
Als gevolg hiervan bevestigden ze het CAF-hermodelleringseffect bij triple-negatieve borstkankermuizen bij een 100-voudig lagere dosering van Tranilast in vergelijking met wanneer Tranilast zonder micellen werd gebruikt (vrije vorm). Dit gaf aan dat de opname van nanomicelle in de tumor en CAF was verbeterd in vergelijking met de vrije vorm. Bovendien verhoogde de combinatie van met Tranilast beladen micellen met nanomedicine (Epirubicine Micelle of Doxil) en immuuncontrolepuntremmers de immuun-T-celinfiltratie in de tumor, wat resulteerde in een volledige respons en immuungeheugen bij muizen met immunotherapie-resistente borstkanker.
Bovendien werden de effecten van met Tranilast geladen micellen op de micro-omgeving van de tumor niet-invasief gevolgd door ultrasone shear wave elastography (SWE) voor een optimale doseringsplanning. De ontdekking dat de behandelingsrespons kan worden voorspeld op basis van SWE-metingen voorafgaand aan de start van de behandeling, is belangrijk en suggereert sterk dat deze beeldvormende modaliteit het potentieel heeft om te worden gebruikt als biomarker voor responsvoorspelling.
Wat is de nieuwigheid van deze studie?
Hypoperfusie is een kenmerk van de micro-omgeving van veel solide tumoren. Het leidt tot hypoxie, lage pH en onvoldoende toediening van medicijnen, wat de werkzaamheid van kankertherapieën, waaronder nanotherapie en immunotherapie, in gevaar brengt. Verminderde bloedtoevoer en de resulterende hypoxische micro-omgeving van de tumor helpen kankercellen ook om het immuunsysteem te omzeilen en hun invasieve en metastatische potentieel te vergroten.
De studie laat zien dat:
- inkapseling van TME-modulerende geneesmiddelen verbetert hun farmacokinetische eigenschappen, terwijl een drastische verlaging van de toedieningsdosis mogelijk is,
- effectieve modulatie van de TME kan leiden tot volledige genezing van nano-immunotherapie in borstkankertumormodellen die resistent zijn tegen deze therapie. Het kan ook immunologisch geheugen opwekken, wat betekent dat tumoren niet opnieuw konden groeien bij dieren die het hadden overleefd omdat het immuunsysteem van de dieren geheugen had gekregen tegen de kankercellijn.
- ultrasone afschuifgolfelastografie kan worden gebruikt voor het optimaliseren van het gebruik van TME-modulerende middelen en voor het voorspellen van de tumorrespons op nano-immunotherapie, waardoor geoptimaliseerde behandelingsprotocollen mogelijk zijn. Shear wave elastography is een klinisch toegepaste, niet-invasieve beeldvormingsmodaliteit om tumorstijfheid te kwantificeren. De studie benadrukt het potentieel van afschuifgolfelastografie en metingen van tumorstijfheid om te worden gebruikt als een biomarker om de werkzaamheid van immunotherapie te voorspellen en tumoren te scheiden van responders en non-responders voorafgaand aan de behandeling.
Waarom zijn deze bevindingen belangrijk en hoe gaat de studie de huidige therapie verbeteren?
De studie is van belang omdat het een nieuwe formulering van nanodeeltjes voorstelt die in plaats van kankercellen direct te doden, de micro-omgeving van de tumor effectief herprogrammeert, waardoor het voor bestaande therapieën gemakkelijker wordt om de tumor te bereiken en zo hun werkzaamheid drastisch te verbeteren.
Het potentieel van deze nieuwe formulering van nanodeeltjes is aangetoond in medicijnresistente borsttumormodellen, maar er wordt verwacht dat het gunstig zal zijn bij andere hypo-perfuse tumoren met overvloedige disfunctionele bloedvaten, zoals alvleesklierkanker, sarcomen en colorectale kankers.
Herstel van de bloedtoevoer in deze tumoren – bereikt met de ontwikkelde tranilast-geladen micellen, samen met de toediening van de juiste cocktail van nanotherapie en immunotherapie – kan een drastische vermindering van de primaire tumorgrootte veroorzaken en longmetastase effectief verminderen, wat resulteert in een aanzienlijke verbetering van de algehele overlevingspercentages en zelfs bij volledige kuren.
Ook benadrukt de identificatie van tumorstijfheid als een belangrijke bepalende factor voor de mate van tumorperfusie het potentiële gebruik van stijfheidsmetingen als biomarkers voor voorspelling van immunotherapie. Tot op heden zijn er geen universele voorspellende biomarkers voor blokkade van immuuncontrolepunten. Biomarkers op basis van de expressie van PD-L1 zijn alleen voorgesteld voor bepaalde tumortypes.
Sommige tumoren reageren echter zelfs wanneer de PD-L1-expressie laag is, terwijl andere niet reageren, zelfs niet wanneer de PD-L1-expressie verhoogd is. Verschillende tumortypes kunnen aanzienlijk verschillende immunologische achtergronden hebben en daarom is de identificatie van gemeenschappelijke voorspellende markers op basis van moleculaire informatie buitengewoon uitdagend.
Aan de andere kant kan tumorstijfheid worden gemeten met niet-invasieve en klinisch beschikbare methoden bij patiënten en moet het worden getest als biomarker in prospectieve onderzoeken. Lopende klinische studies in samenwerking met het Duitse Oncologiecentrum (Limassol, Cyprus) en het Oncologiecentrum van de Bank of Cyprus (Nicosia, Cyprus) hebben tot doel de kennis verkregen uit de preklinische studies over te dragen naar de klinische setting.
Meer informatie:
Myrofora Panagi et al, Polymere micellen herprogrammeren effectief de micro-omgeving van de tumor om nano-immunotherapie in borstkankermodellen bij muizen te versterken, Natuurcommunicatie (2022). DOI: 10.1038/s41467-022-34744-1
Tijdschrift informatie:
Natuurcommunicatie
Aangeboden door Innovatiecentrum van NanoMedicine