Schematische illustratie van verbeterde tumorimmunotherapie met behulp van DC-therapie gemedieerd door metaalion-gechelateerde L-fenylalanine nanocomplexen. Credit: Natuur Nanotechnologie (2024). DOI: 10.1038/s41565-024-01758-3
Immune checkpoint blockade (ICB) is een van de primaire methoden van tumorimmunotherapie. Klinische gegevens hebben echter aangetoond dat slechts een deel van de patiënten reageert op ICB-behandeling. Aangezien de immuunonderdrukkende omgeving van de tumor een cruciale rol speelt bij ICB-therapie, is het vinden van manieren om deze omgeving effectief te hervormen en de respons op ICB-behandeling te verhogen een belangrijk aandachtspunt geworden.
In een studie gepubliceerd in Natuur Nanotechnologieeen onderzoeksteam onder leiding van Prof. Wang Hai en Nie Guangjun van het Nationaal Centrum voor Nanowetenschappen en Technologie van de Chinese Academie van Wetenschappen, in samenwerking met Prof. Ran Haitao van de Chongqing Medische Universiteit, ontwikkelde drie soorten nanostructuren die L-fenylalanine combineren met metaalionen.
Dit innovatieve ontwerp kan de immuunonderdrukkende omgeving van de tumor effectief veranderen en de effectiviteit van ICB-immunotherapie aanzienlijk verbeteren.
Dendritische cellen (DC’s) spelen een cruciale rol in de immuunrespons tegen kanker en infecties. Rijpe DC’s zijn de sleutel tot het activeren van tumorspecifieke immuniteit. In het afgelopen decennium zijn twee belangrijke activeringsmodi ontdekt om DC-rijping te induceren en de initiële immuunrespons te triggeren: pathogeen-geassocieerde moleculaire patronen (PAMP’s) en schade-geassocieerde moleculaire patronen (DAMP’s).
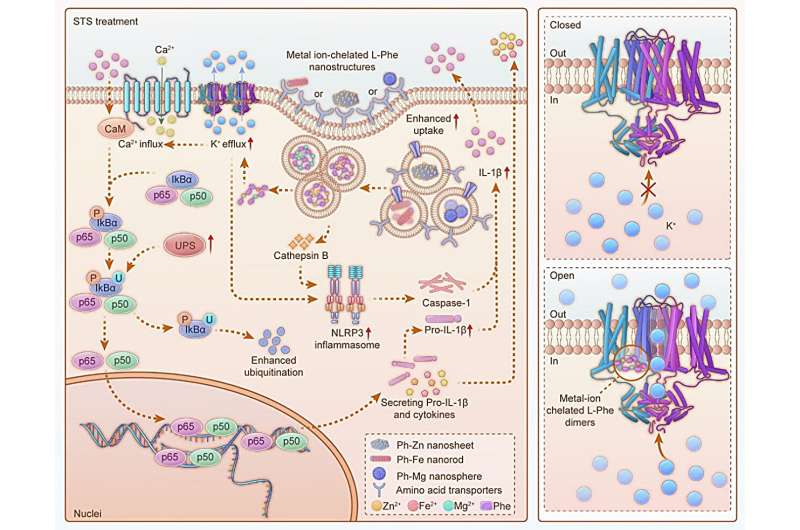
Naast deze gevaarsignalen worden veel functies van DC’s, waaronder rijping, cytokineproductie en migratie, ook gereguleerd door elektrische signalen in het lichaam. De concentratie van kalium- en calciumionen in DC’s is nauw verwant aan hun rijpingsproces. De beweging van metaalionen in en uit cellen wordt echter strikt gecontroleerd door ionkanalen en er is momenteel geen effectieve manier om deze kanalen te activeren.
Om de kaliumionkanalen op het DC-membraan te activeren, gebruikten de onderzoekers magnesiumionen, ijzerionen en zinkionen om te coördineren met L-fenylalanine, waardoor drie soorten nanostructuren ontstonden: nanosferen (Ph–Mg), nanonaalden (Ph–Fe) en nanosheets (Ph–Zn). Ze ontdekten dat deze nanomaterialen cellen konden binnendringen via pinocytose en caveolae-gemedieerde endocytose, maar dat ze instabiel waren in zure omgevingen.
Computersimulaties gaven aan dat de gedemonteerde nanostructuren zouden vrijkomen als dimeren van metaalion-gechelateerde L-fenylalanine. Deze dimeren kunnen zich binden aan het S4-transmembraangebied van het kaliumionkanaal (Kv1.3), waardoor de Kv1.3-structuur verandert, het kanaal breder wordt en het kaliumionkanaal wordt geactiveerd.
De uitstroom van kaliumionen, samen met de instroom van calciumionen die wordt veroorzaakt door depolarisatie, activeert de NF-κB-signaalroute die wordt gereguleerd door calmoduline, waardoor de DC-rijping wordt bevorderd en de secretie van pro-inflammatoire cytokinen wordt geactiveerd.
Bovendien ontdekten de onderzoekers dat de opname van nanostructuren door DC’s de afgifte van cathepsine B kan induceren, wat, samen met de uitstroom van kaliumionen, het inflammasome-pad activeert dat nauw verwant is aan DC-rijping. Ze toonden aan dat beperking van voedingsstoffen de opname van nanomaterialen door DC’s kan verbeteren, de calmoduline-expressie kan verhogen en IkBα kan afbreken, wat het NF-κB-pad verder kan versterken.
“Momenteel richt de meeste proteïneregulatie zich op het ontwikkelen van remmers. Het vinden van manieren om proteïnefuncties te activeren is nog steeds een uitdaging,” aldus Prof. Wang, de hoofdauteur van deze studie. “Gelukkig ontdekten we dat nanomedicijnen het Kv1.3-kaliumionkanaal in DC’s nauwkeurig kunnen activeren. Deze activering keert de immuunonderdrukkende omgeving van de tumor om en verbetert de effectiviteit van immuuncontrolepuntremmers.”
De onderzoekers ontwikkelden metaalion-aminozuur nanostructuren die ionkanaalstructuren kunnen reguleren, en zo de activering van de aangeboren immuunrespons bevorderen door de kalium- en calciumionen in DC’s aan te passen. Dit hervormt de immuunonderdrukkende omgeving van de tumor, wat een nieuwe strategie biedt om de effectiviteit van ICB-therapie te verbeteren.
Meer informatie:
Mixiao Tan et al, Metaalion-chelerende fenylalanine nanostructuren keren immuundisfunctie om en maken borsttumoren gevoeliger voor immuuncontrolepuntblokkade, Natuur Nanotechnologie (2024). DOI: 10.1038/s41565-024-01758-3
Tijdschriftinformatie:
Natuur Nanotechnologie
Geleverd door de Chinese Academie van Wetenschappen