Credit: Nano-brieven (2024). DOI: 10.1021/acs.nanolett.4c01263
Amyloid-beta (A-beta) aggregaten zijn kluwens van eiwitten die vooral geassocieerd worden met neurodegeneratieve ziekten zoals Alzheimer. Ondanks de constante aandacht voor A-beta, zijn onderzoekers er echter niet in geslaagd om een goed begrip te krijgen van hoe A-beta samenkomt en uiteenvalt.
“De manier waarop A-beta zich gedraagt in verschillende omgevingen, waaronder het menselijk brein, is ongrijpbaar,” zei Brian Sun, een alumnus van elektrische systemen en techniek aan de Washington University in St. Louis, die nu MD/Ph.D.-student is aan de School of Medicine. “Er is een begrip van groei en verval dat nog niet volledig is uitgewerkt.”
Dat gaat veranderen, dankzij recent onderzoek gepubliceerd in Nano-brieven door Sun met collega’s in het laboratorium van Matthew Lew in de Preston M. Green Department of Electrical & Systems Engineering aan de McKelvey School of Engineering van WashU.
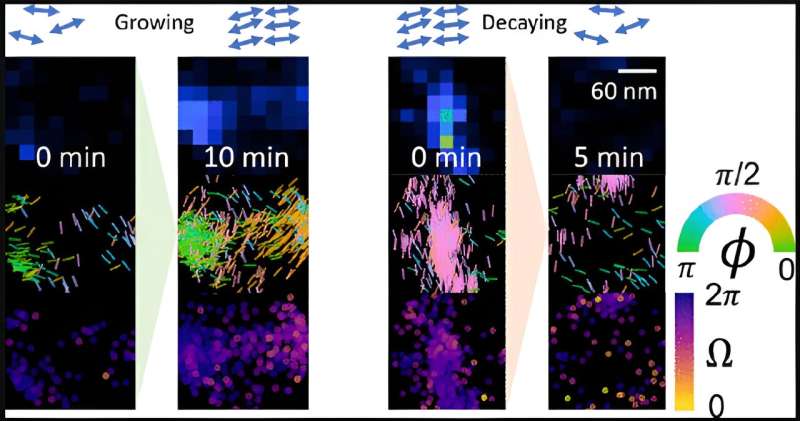
In het eerste werk in zijn soort konden Sun en collega’s amyloïde fibril-beta-sheet-assemblages, de onderliggende liggers van de eiwitconglomeratie, meten terwijl ze veranderden. Eerdere microscopiestudies met hoge resolutie leverden alleen statische opnamen op.
“We wilden specifiek kijken naar de dynamiek van de onderliggende structuur van A-bèta die verantwoordelijk zou kunnen zijn voor de veranderingen die we zien, niet alleen veranderingen in de algehele vorm”, aldus Sun, de eerste auteur van het artikel.
Lew gebruikte Lego-steentjes in een vergelijking en merkte op dat de huidige beeldtechnologie je het volledige Lego-gebouw laat zien, maar niet hoe de afzonderlijke stenen zijn geordend.
“De individuele eiwitten veranderen voortdurend als reactie op hun omgeving,” aldus universitair hoofddocent Lew. “Het is alsof bepaalde Lego-blokjes ervoor zorgen dat andere blokjes van vorm veranderen. De veranderende architectuur van de eiwitten en de samengevoegde aggregaten leiden tot de complexiteit van neurodegeneratieve ziekten.”
Het Lew-lab heeft een nieuw type beeldvormingstechnologie ontwikkeld waarmee onderzoekers de oriëntatie en andere kleine details in nanostructuren van biologische systemen kunnen zien die voorheen onzichtbaar waren. Hun techniek, single-molecule orientation-localization microscopy (SMOLM), gebruikt lichtflitsen van chemische probes om de vellen peptiden te visualiseren die ten grondslag liggen aan Aβ42, een soort A-beta-peptide.
Met behulp van SMOLM kunnen ze de individuele oriëntatie van de onderliggende bètabladen bekijken om de relatie tussen hun organisatie en de manier waarop die zich verhoudt tot de algehele structuur van het amyloïde-eiwit te bekijken.
Meerdere manieren om te verbouwen
Aβ42 verandert voortdurend en de eerste stap is om te proberen een methode te vinden voor deze waanzin, een model of patroon van actie om het gedrag van het eiwit te voorspellen.
Nu het Lew-lab deze metingen kan uitvoeren, deden ze een aantal intuïtieve observaties en ontdekten ze een aantal verrassingen die verborgen zaten in de amyloid-bèta-architectuur.
Zoals verwacht, hebben stabiele Aβ42-structuren de neiging om stabiele onderliggende bèta-sheets te behouden; groeiende structuren hebben onderliggende bèta-sheets die meer gedefinieerd en rigide worden naarmate de groei doorgaat. Vervallende structuren vertonen steeds meer ongeordende en minder rigide bèta-sheets. Maar ze vonden ook meer dan één manier waarop Aβ42 kan renoveren.
“Er zijn verschillende manieren waarop Aβ42-structuren stabiel blijven, of groeien en vervallen”, aldus Sun.
De onderzoekers ontdekten ook dat Aβ42 kan groeien en vervallen op manieren die de verwachtingen tarten. Aβ42 kan bijvoorbeeld groeien en vervallen op manieren die de onderliggende structuur behouden; soms is er groei waarbij de peptiden zich gewoon opstapelen, maar de onderliggende bèta-sheet-oriëntaties niet veranderen. In andere gevallen ondergaat Aβ42 “stabiel verval”, waarbij het tegenovergestelde gebeurt, d.w.z. peptiden vertrekken, maar de bèta-sheet-structuur blijft.
Ten slotte reorganiseren de bèta-sheets van Aβ42 zich soms en veranderen ze van oriëntatie zonder dat dit direct gepaard gaat met veranderingen in de algehele vorm. Deze nanostructurele reorganisaties kunnen predisponeren voor toekomstige grootschalige hermodellering.
“Omdat SMOLM de onderliggende organisatie van Aβ42 kan volgen en niet alleen de vorm, kunnen we verschillende soorten subtypen van hermodellering zien die niet zichtbaar zijn met diffractiegelimiteerde, niet-georiënteerde beeldvormingsmodaliteiten”, aldus Sun.
Als het allemaal wat vaag klinkt, bedenk dan dat dit de eerste poging is om deze constant veranderende nanoschaalstructuren te bekijken. Het is des te opmerkelijker dat Sun dit werk maakte terwijl hij de COVID-19-lockdownbeperkingen combineerde met zijn bacheloropleiding aan WashU, die hij in drie jaar afrondde. Het maakt de weg vrij voor hem en anderen om echt grip te krijgen op de amyloïdearchitectuur.
Tijdens de afstudeerfase van zijn MD/Ph.D.-opleiding wil Sun nanoschaalbeeldvormingssystemen en sensoren ontwerpen die de verborgen mechanismen van moeilijk te behandelen ziekten kunnen onthullen.
Sun dankt McKelvey Engineering en het Lew lab voor de rigoureuze training die deze studie en academische loopbaan mogelijk maakte, evenals de MSTP voor het ondersteunen van zijn voortdurende onderzoek na zijn afstuderen. “Ik ben erg blij dat ik deze reis heb gemaakt,” zei hij.
Meer informatie:
Brian Sun et al, Single-Molecule Orientation Imaging onthult de nano-architectuur van amyloïde fibrillen die groei en verval ondergaan, Nano-brieven (2024). DOI: 10.1021/acs.nanolett.4c01263
Tijdschriftinformatie:
Nano-brieven
Geleverd door Washington University in St. Louis