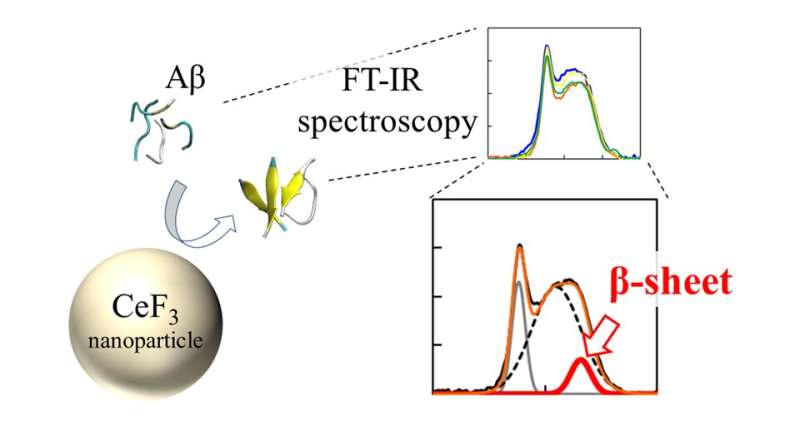
Infrarood (FT-IR) spectra en β-sheet-verhouding van Aβ-peptiden interageerden met CeF3 NP’s. Het effect van CeF3-nanodeeltjes op de amyloïde bèta-eiwitstructuur wordt direct gemeten met FT-IR-spectroscopie. De vorming van secundaire structuur verschijnt als een kenmerk in het IR-spectrum. Credit: Masakazu Umezawa / Tokyo University of Science, Licentietype: CC BY 4.0
Eiwitfunctie en activiteit worden bepaald door zowel hun assemblage als secundaire structuur. Afwijkingen die verband houden met eiwitaggregatie of secundaire structuur kunnen leiden tot neurodegeneratieve ziekten. In een nieuwe studie onthult een internationaal onderzoeksteam hoe fluoride-nanodeeltjes, materialen die worden gebruikt in in vivo beeldvorming, de assemblage en structuur van het amyloïde β-eiwit beïnvloeden. Hun resultaten vormen een stap in de richting van een betere behandeling en preventie van neurologische aandoeningen zoals de ziekte van Alzheimer.
Zelfassemblage, of de associatie van individuele eenheden van een materiaal in geordende structuren of patronen, is een fenomeen van groot onderzoeksbelang voor materiaalwetenschappers. Een prominent voorbeeld van zelfassemblage komt van de zelfassemblage van eiwitten in biologische systemen. De functie en activiteit van eiwitten worden bepaald door hun assemblagestaat. Bovendien speelt de “secundaire structuur” van het eiwit, gekenmerkt door zijn vouwing in structuren, zoals een β-sheet, ook een rol. In feite kunnen afwijkingen in de secundaire eiwitstructuren of hun assemblage leiden tot verschillende neurodegeneratieve ziekten, waaronder de ziekte van Alzheimer.
Nanodeeltjes (NP’s) bieden een veelbelovende route voor de behandeling en preventie van dergelijke ziekten door een gecontroleerde en gerichte medicijnafgifte mogelijk te maken. Bovendien worden anorganische NP’s, zoals fluoride-NP’s, gebruikt in toepassingen voor hersenbeeldvorming. In vergelijking met organische NP’s worden anorganische NP’s beschouwd als een betere kandidaat voor het ontwikkelen van hoogfunctionele materialen. Maar er is veel bezorgdheid over hun biotoxiciteit. Hoewel hun interacties met bio-eiwitten zijn bestudeerd, wordt het onderliggende mechanisme van deze interacties niet goed begrepen.
Een internationaal team van wetenschappers van de Tokyo University of Science (TUS) in Japan en de Nazarbayev University in Kazachstan heeft dit probleem nu aangepakt. In hun onderzoek, dat op 2 juni 2022 online beschikbaar werd gesteld en in het tijdschrift werd gepubliceerd ACS toegepaste biomaterialen op 20 juni 2022 onderzocht het team een deel van het amyloïde β-peptide (een eiwit dat wordt aangetroffen in de plaques die zich vormen in de hersenen van patiënten met de ziekte van Alzheimer) in een oplossing met fluoridekeramiek (CeF3) NP’s. Het onderzoek werd geleid door junior universitair hoofddocent Masakazu Umezawa en omvatte bijdragen van de heer Naoya Sakaguchi van TUS en assistent-hoogleraren Mehdi Amouei Torkmahalleh en Dhawal Shah van de Nazarbayev University.
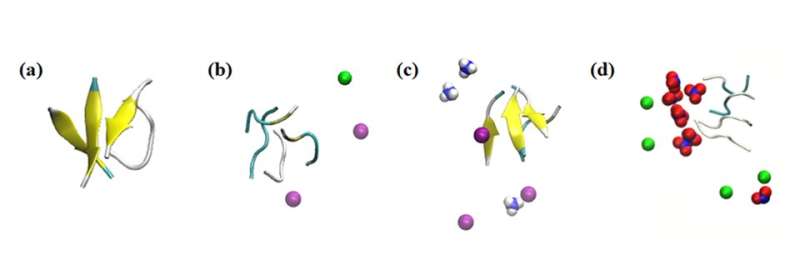
Simulatiesnapshots van de interacties van het peptideaggregaat met verschillende ionen. Simulatieresultaten van het effect van ionen binnen 0,1 nm op de peptiden in de onderzochte systemen: (a) geen zout, (b) 0,15 M NaCl, (c) 0,15 M NH4Cl en (d) 0,15 M NaNO3. Kleur: bètablad = geel; Na+ = groen; NH4+ = blauw en wit; Cl- = paars; en NO3− = blauw en rood. Credit: Masakazu Umezawa / Tokyo University of Science, Licentietype: CC BY 4.0
Het team gebruikte een techniek genaamd “Fourier-transformatie-infraroodspectroscopie” (FTIR) om het effect van het NP-oppervlak op de peptidebindingen direct te volgen. “We ontdekten dat peptiden in de buurt van het oppervlak van nanodeeltjes meer kans hebben om β-sheets te vormen. Dit komt als een effect van hydrofobiciteit. De delen van het peptide die worden afgestoten door de wateroplossing, kleven aan de nanodeeltjes en vormen gemakkelijker aggregaten.” legt dr. Umezawa uit.
Daarnaast onderzocht het team het effect van andere omringende ionen in de oplossing. “Wat we vonden was zeer verrassend. Zelfs zonder de nanodeeltjes had de omgeving invloed op de snelheid van secundaire structuurvorming”, zegt Dr. Umezawa. “Dit effect, als gevolg van een combinatie van elektrostatische interactie en waterstofbinding, was overdreven bij het toevoegen van nanodeeltjes. Met een zorgvuldige keuze van ionen en nanodeeltjes kan de vorming van β-sheets worden onderdrukt of bevorderd. Dit houdt in dat het proces kan worden gecontroleerd en gemanipuleerd om nadelige effecten uit te roeien.”
De experimentele resultaten werden aangevuld met moleculaire dynamica-simulaties uitgevoerd door het team van de Nazarbayev University. Dit hielp op zijn beurt bij het ontwerpen en begeleiden van de experimenten en het verschaffen van inzicht in de resultaten.
Met dit diepere begrip van de interactie tussen eiwitten en NP’s, maakt de studie de weg vrij voor gecontroleerde eiwitvouwprocessen. Met een dergelijke controle zouden eventuele eiwitvervormingen kunnen worden geëlimineerd en zouden positieve interacties en structurele veranderingen kunnen worden bevorderd. Dit zou kunnen leiden tot een beter preventie- en behandelprotocol voor de ziekte van Alzheimer en uiteindelijk tot een betere kwaliteit van leven van bejaarde volwassenen.
Naoya Sakaguchi et al, Veranderingen in de secundaire structuur en assemblage van eiwitten op fluorkeramische (CeF3) nanodeeltjesoppervlakken, ACS toegepaste biomaterialen (2022). DOI: 10.1021/acsabm.2c00239
Geleverd door Tokyo University of Science