Credit: Natuur Nanotechnologie (2022). DOI: 10.1038/s41565-022-01122-3
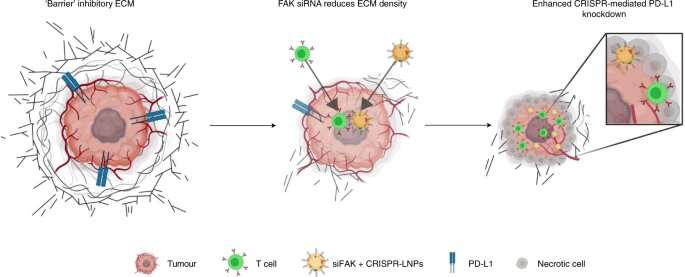
Naarmate ze groeien, omringen solide tumoren zich met een dikke, moeilijk te penetreren muur van moleculaire afweer. Drugs voorbij die barricade krijgen is notoir moeilijk. Nu hebben wetenschappers van UT Southwestern nanodeeltjes ontwikkeld die de fysieke barrières rond tumoren kunnen doorbreken om kankercellen te bereiken. Eenmaal binnen laten de nanodeeltjes hun lading los: een genbewerkingssysteem dat het DNA in de tumor verandert, de groei blokkeert en het immuunsysteem activeert.
De nieuwe nanodeeltjes, beschreven in Natuur Nanotechnologie, stopte effectief de groei en verspreiding van eierstok- en levertumoren bij muizen. Het systeem biedt een nieuwe weg voorwaarts voor het gebruik van de tool voor het bewerken van genen die bekend staat als CRISPR-Cas9 bij de behandeling van kanker, zei onderzoeksleider Daniel Siegwart, Ph.D., universitair hoofddocent biochemie aan de UT Southwestern.
“Hoewel CRISPR een nieuwe benadering biedt voor de behandeling van kanker, wordt de technologie ernstig gehinderd door de lage efficiëntie van het afleveren van nuttige ladingen in tumoren”, zegt Dr. Siegwart, een lid van het Harold C. Simmons Comprehensive Cancer Center.
De afgelopen jaren heeft de CRISPR-Cas9-technologie onderzoekers een manier gegeven om het DNA in levende cellen selectief te bewerken. Hoewel het genbewerkingssysteem het potentieel biedt om genen te veranderen die de groei van kanker stimuleren, was het een uitdaging om CRISPR-Cas9 aan solide tumoren te leveren.
Al meer dan tien jaar bestuderen en ontwerpen Dr. Siegwart en zijn collega’s lipidenanodeeltjes (LNP’s), kleine bolletjes vetmoleculen die moleculaire lading (inclusief recente mRNA COVID-19-vaccins) in het menselijk lichaam kunnen vervoeren. In 2020 liet de groep van Dr. Siegwart zien hoe nanodeeltjes naar specifieke weefsels kunnen worden gestuurd, wat een uitdaging was om het veld te beperken.
In het nieuwe werk, om kanker te bestrijden, begonnen de onderzoekers met de nanodeeltjes die ze al hadden geoptimaliseerd om naar de lever te reizen. Ze voegden een klein stukje RNA toe (kort interfererend RNA of siRNA genoemd) dat focale adhesiekinase (FAK) zou kunnen uitschakelen, een gen dat een centrale rol speelt bij het bijeenhouden van de fysieke afweer van een aantal tumoren.
“Het richten op FAK verzwakt niet alleen de barricade rond tumoren en maakt het voor de nanodeeltjes zelf gemakkelijker om hun weg naar de tumor te vinden, maar maakt ook de weg vrij om immuuncellen binnen te laten”, zegt Di Zhang, Ph.D., een postdoctoraal onderzoek. fellow bij UTSW en eerste auteur van het papier.
In de nieuw ontworpen nanodeeltjes hebben de onderzoekers CRISPR-Cas9-machines ingekapseld die het gen PD-L1 konden bewerken. Veel kankers gebruiken dit gen om hoge niveaus van het PD-L1-eiwit te produceren, wat een rem zet op het vermogen van het immuunsysteem om tumoren aan te vallen. Wetenschappers hebben eerder aangetoond dat het verstoren van het PD-L1-gen, bij sommige vormen van kanker, die remmen kan opheffen en het immuunsysteem van een persoon in staat kan stellen kankercellen te doden.
Drs. Siegwart, Zhang en hun collega’s testten de nieuwe nanodeeltjes in vier muismodellen van eierstok- en leverkanker. Ze toonden eerst aan dat door siRNA toe te voegen om FAK af te sluiten, de matrix van moleculen rond de tumoren minder stijf was en gemakkelijker te penetreren dan normaal. Vervolgens analyseerden ze de tumorcellen en ontdekten dat veel meer nanodeeltjes de cellen hadden bereikt, waardoor het PD-L1-gen effectief veranderde.
Ten slotte ontdekten ze dat tumoren bij muizen die werden behandeld met de nanodeeltjes die zowel op FAK als op PD-L1 waren gericht, kromp tot ongeveer een achtste van de grootte van tumoren die alleen met lege nanodeeltjes werden behandeld. Bovendien drongen meer immuuncellen de tumoren binnen en overleefden de behandelde muizen gemiddeld ongeveer twee keer zo lang.
Er is meer werk nodig om de veiligheid en werkzaamheid van de nanodeeltjes in verschillende tumortypes aan te tonen. De onderzoekers zeiden dat de therapie nuttig kan zijn in combinatie met bestaande immuuntherapieën voor kanker die erop gericht zijn het immuunsysteem te gebruiken om tumoren aan te vallen.
“Na het wereldwijde succes van de COVID-19 LNP-vaccins, vragen we ons allemaal af wat LNP’s nog meer kunnen doen. Hier hebben we nieuwe LNP’s ontwikkeld die in staat zijn om meerdere soorten genetische geneesmiddelen tegelijk af te leveren om de therapeutische resultaten bij kanker te verbeteren. Er is duidelijk een groot potentieel voor LNP-medicijnen voor de behandeling van verschillende soorten ziekten,” zei Dr. Siegwart.
Di Zhang et al, Verbetering van CRISPR/Cas-genbewerking door cellulaire mechanische eigenschappen voor kankertherapie te moduleren, Natuur Nanotechnologie (2022). DOI: 10.1038/s41565-022-01122-3
Natuur Nanotechnologie
Geleverd door UT Southwestern Medical Center