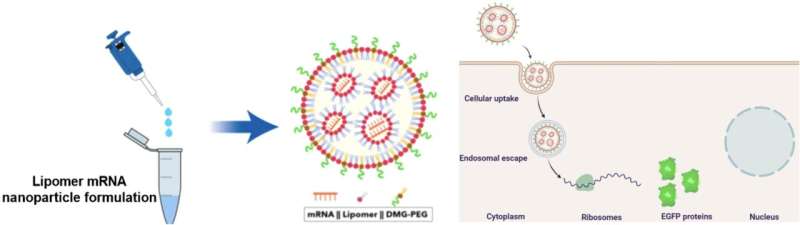
Het lipomeer wordt gecombineerd met mRNA en DMG-PEG om mRNA-dragende nanodeeltjes (NP’s) te vormen. Deze NP’s kunnen de lever omzeilen om het mRNA rechtstreeks aan de longcellen af te leveren. De wetenschappers gebruikten mRNA dat codeert voor verbeterd groen fluorescerend eiwit (EGFP) voor visualisatie van de eiwitten. Krediet: Mahmoud M. Abd Elwakil, et al., Materialen Horizons. 7 juni 2021
Onderzoekers van de Hokkaido University in Japan hebben een bibliotheek van op lipiden gebaseerde verbindingen gemaakt en getest om een manier te vinden om RNA-medicijnen veilig en effectief aan de longen te leveren. Hun analyses, gepubliceerd in het tijdschrift Materials Horizons, wezen op een lipidepolymeer dat in de toekomst zou kunnen worden gebruikt voor de behandeling van acuut respiratoir distress syndroom, pulmonale hypertensie en longkanker.
De pandemische reactie van COVID-19 heeft ons allemaal bekend gemaakt met RNA-vaccins die genetische code in cellen vervoeren om de productie van viruseiwitten aan te zetten die onze beschermende immuniteit activeren. RNA-medicijnen laten een groot potentieel zien voor de behandeling van een grote verscheidenheid aan andere ziekten door op dezelfde manier de eiwitproductie in cellen te sturen, zonder dat DNA hoeft te worden ingevoegd of verwijderd. Maar wetenschappers worden geconfronteerd met verschillende uitdagingen bij hun veilige levering aan gerichte cellen. Een succesvolle maar complexe benadering omvat het dragen van de RNA-codes in nanodeeltjes die zijn bedekt met verbindingen, targeting-liganden genaamd, die aan specifieke cellen kunnen binden. Dit heeft gewerkt voor het richten van levercellen.
De farmaceutisch wetenschapper Hideyoshi Harashima van Hokkaido University en polymeerchemicus Toshifumi Satoh leidden een team van onderzoekers bij het ontwikkelen en testen van een bibliotheek van op ε-decalacton gebaseerde verbindingen, lipiden die de lever kunnen omzeilen – die toxines en vreemde stoffen afbreekt – en specifiek RNA-code afleveren in de longen. Harashima ontving onlangs de Høst-Madsen-medaille, de hoogste wetenschappelijke onderscheiding die wordt toegekend door The International Pharmaceutical Federation (FIP).
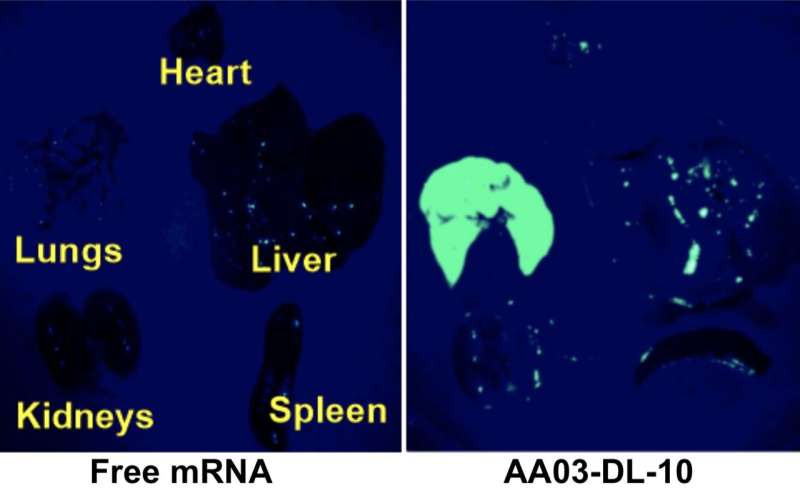
Vrij mRNA richtte zich op geen enkel orgaan (links), terwijl NP’s die lipomeer AA03-DL-10 bevatten specifiek mRNA dat voor EGFP codeert, naar de longen transporteerden en acht uur na intraveneuze toediening aan muizen groene fluorescerende eiwitten produceerden. Krediet: Mahmoud M. Abd Elwakil, et al., Materialen Horizons, 7 juni 2021
De wetenschappers werkten met twee nauw verwante ringvormige verbindingen: ε-caprolacton en ε-decalacton. Van lipidenanodeeltjes (NP’s) die deze lactonen bevatten, werd eerder aangetoond dat ze zich ophopen in de longen. Ze werden onderworpen aan ringopeningsreacties met een van de elf aminoalcoholen. De resulterende producten werden verder geclassificeerd op basis van het molecuulgewicht van elke arm. De producten werden gecombineerd met mRNA en een andere verbinding genaamd DMG-PEG om mRNA-dragende NP’s te vormen. NP’s gemaakt van ε-caprolacton waren onstabiel, dus het team ging alleen verder met de NP’s van ε-decalacton.
Het team testte de afgifte van RNA-dragende ε-decalacton-NP’s eerst in laboratoriumkankercellen en vervolgens intraveneus in muizen. Ze gebruikten mRNA dat codeert voor verbeterd groen fluorescentie-eiwit (EGFP) om de bestemming van de NP’s te identificeren. Uiteindelijk ontdekten ze dat ε-decalacton in combinatie met een lineaire aminoalcohol genaamd AA03 het beste resultaat opleverde. De onderzoeken toonden aan dat NP’s die dit lipomeer bevatten in staat waren grotendeels de lever te omzeilen en het RNA-materiaal specifiek in de longen te transporteren. De NP’s werden opgeslokt door het celmembraan en het RNA-gehalte kwam vrij in het cytoplasma van de longcellen.
“We hebben aangetoond dat het uitbreiden van de chemische ruimte van slimme materialen de fabricage van nanodeeltjes voor moeilijk bereikbare doelen mogelijk zou kunnen maken zonder de noodzaak om liganden te targeten”, zegt Harashima. “Het ontwerpen van combinatorische bibliotheken die diverse ε-decalacton-lipomeren bieden, zou een gemakkelijke en schaalbare strategie kunnen zijn voor de ontwikkeling van gentherapieën van de volgende generatie voor organen buiten de lever.”
Mahmoud M. Abd Elwakil et al, Engineered ε-decalactone-lipomeren omzeilen de lever om selectief in vivo mRNA aan de longen af te leveren zonder zich op liganden te richten, Materialen Horizons (2021). DOI: 10.1039/d1mh00185j
Geleverd door Hokkaido University