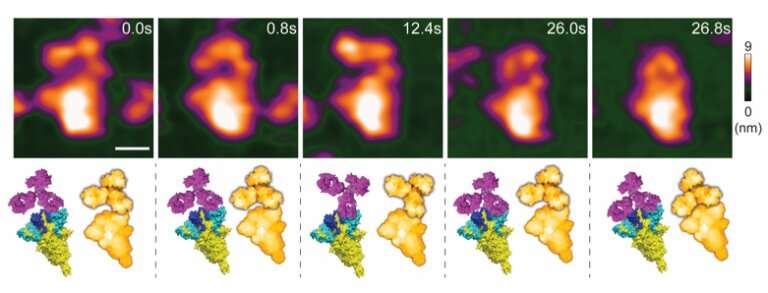
High-speed atomic force microscopie visualisatie van een spike-neutraliserend antilichaam dat reageert met een spike-eiwit. Krediet: Lim et al
Dat melden onderzoekers van Kanazawa University Nano-brieven hoe supersnelle atoomkrachtmicroscopie kan worden gebruikt om de effectiviteit van spike-neutraliserende antilichamen voor het voorkomen van COVID-19 te beoordelen. Het gebruik van dergelijke antilichamen biedt een veelbelovend alternatief voor vaccins.
Vaccins tegen coronavirusziekte 2019 (COVID-19) ontwikkeld en geproduceerd tijdens de COVID-19-pandemie bieden een aanzienlijke mate van bescherming. Na de tweede dosis van een vaccin duurt de bescherming echter maar maximaal acht maanden en zijn daarna meerdere boosterdoses nodig.
Een alternatieve weg naar preventie en behandeling van COVID-19 ligt in zogenaamde spike-neutraliserende antilichamen (SNAB’s) die het effect neutraliseren van het spike-eiwit van het SARS-CoV-2-virus, het eiwit dat de binnenkomst van het virus in een gastheer bemiddelt cel. Het goed kunnen bestuderen van de interacties tussen SARS-CoV-2-spike-eiwitten en SNAB’s is cruciaal voor het ontwikkelen van een effectieve behandeling – het dynamisch visualiseren van deze interacties is bijzonder wenselijk.
Keesiang Lim van Kanazawa University en collega’s zijn er nu in geslaagd om eiwit-SNAB-interacties op video af te beelden door middel van snelle atoomkrachtmicroscopie (HS-AFM). Ze waren in staat om de moleculaire mechanismen die een rol spelen te identificeren en toonden daarmee aan dat HS-AFM een uniek nanoscopisch beoordelingsplatform biedt voor het evalueren van de intermoleculaire bindingseigenschappen van SNAB’s.
Een van de belangrijkste redenen voor de noodzaak om eiwit-SNAB-interacties te bestuderen, is om te controleren of ze niet leiden tot een fenomeen dat antilichaamafhankelijke versterking (ADE) wordt genoemd, wat verwijst naar de situatie waarin een virus zijn intredepotentieel vergroot door zich te binden aan een “suboptimaal” antilichaam. Lim en collega’s gebruikten HS-AFM om het ADE-risico te onderzoeken, aangezien de methode een krachtige nanoimaging-tool is voor het visualiseren van moleculaire structuren en de dynamiek van biochemische interacties met virussen.
De wetenschappers keken eerst hoe een spike-eiwit van het SARS-CoV-2-virus zich bindt aan een SNAB. Ze identificeerden hoe de structuur van het eiwit-SNAB-complex infectie blokkeert en konden concluderen dat, op basis van de verkregen structurele informatie, het ADE-risico verwaarloosbaar is. Om vervolgens de dynamische interactie tussen SNAB’s en varianten van het SARS-CoV-2-virus te simuleren, creëerden Lim en collega’s kleine extracellulaire blaasjes (“biocontainers” omgeven door een membraan, die zich buiten de cellen bevinden) die spike-eiwitten kunnen produceren. Uit deze experimenten concludeerden de onderzoekers dat virale oppervlakteruwheid de besmettelijkheid van SARS-CoV-2-varianten kan vergroten. Ze ontdekten ook dat SNAB het spike-eiwit van de deltavariant kon neutraliseren.
Het werk van Lim en collega’s laat zien dat HS-AFM een uitstekende nanoscopische beoordelingstool biedt voor het bestuderen van het bindingspatroon van SNAB’s en de dynamische interactie tussen SNAB’s en spike-eiwit-nabootsende extracellulaire blaasjes. De onderzoekers citerend: “Deze resultaten zijn essentieel voor de screening van geschikte SNAB’s met een lager risico op ADE om COVID-19 te behandelen.”
High-speed atoomkrachtmicroscopie
Het algemene principe van atoomkrachtmicroscopie (AFM) is om met een zeer kleine tip het oppervlak van een monster te scannen. Tijdens deze horizontale (xy) scan volgt de tip, die aan een kleine cantilever is bevestigd, het verticale (z) profiel van het monster, waardoor een kracht op de cantilever wordt opgewekt die kan worden gemeten. De grootte van de kracht op de xy-positie kan worden gerelateerd aan de z-waarde; de xyz-gegevens die tijdens een scan worden gegenereerd, resulteren vervolgens in een hoogtekaart met structurele informatie over het onderzochte monster.
Bij high-speed-AFM (HS-AFM) is het werkingsprincipe iets meer betrokken: de cantilever wordt gemaakt om te oscilleren in de buurt van zijn resonantiefrequentie. Wanneer de tip over een oppervlak wordt bewogen, worden de variaties in de amplitude (of de frequentie) van de oscillatie van de cantilever – die het resultaat is van de interactie van de tip met het oppervlak van het monster – geregistreerd, aangezien deze een maat vormen voor de lokale “z” -waarde. AFM heeft geen lenzen, dus de resolutie wordt niet beperkt door de zogenaamde diffractielimiet zoals bijvoorbeeld bij röntgendiffractie.
HS-AFM resulteert in een video, waarbij het tijdsinterval tussen de frames afhangt van de snelheid waarmee een enkel beeld kan worden gegenereerd (door het sample xy-scannen). Onderzoekers van Kanazawa University hebben de afgelopen jaren HS-AFM verder ontwikkeld, zodat het kan worden toegepast om biochemische moleculen en biomoleculaire processen real-time te bestuderen. Keesiang Lim en collega’s hebben nu een methode toegepast om het proces te bestuderen waarbij een spike-neutraliserend antilichaam zich bindt aan het SARS-CoV-2-virus, waardoor wordt voorkomen dat het een gastheercel binnendringt.
Meer informatie:
Keesiang Lim et al, Nanoscopische beoordeling van anti-SARS-CoV-2 Spike neutraliserend antilichaam met behulp van snelle AFM, Nano-brieven (2023). DOI: 10.1021/acs.nanolett.2c04270
Tijdschrift informatie:
Nano-brieven
Aangeboden door de Kanazawa-universiteit