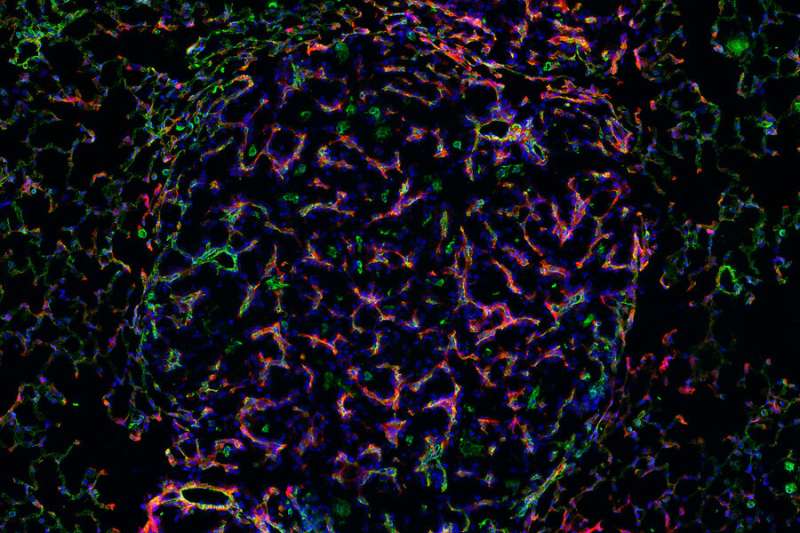
Onderzoekers van het Bhatia Lab ontwikkelden gerichte nanosondes om enzymactiviteit te meten op zeer specifieke locaties in kankerweefsel. Deze afbeelding toont de sondes (rood) die zich lokaliseren naar bloedvaten (groen) in longkankertumoren, waar actieve enzymen nieuw aangeworven bloedvaten helpen de groeiende tumor te voeden. Krediet: Ava P. Amini et al
Kanker wordt gekenmerkt door een aantal belangrijke biologische processen die bekend staan als de “kenmerken van kanker”, die cellen en hun directe omgeving hermodelleren zodat tumoren kunnen vormen, groeien en bloeien. Veel van deze veranderingen worden gemedieerd door specifieke genen en eiwitten, die samenwerken met andere cellulaire processen, maar de specifieke kenmerken variëren van kankertype tot kankertype en zelfs van patiënt tot patiënt.
Gevoelige hulpmiddelen voor het meten van eiwit- of genexpressie, zelfs op het niveau van een enkele cel, hebben onderzoekers geholpen de verschillende celtypen in de micro-omgeving van een tumor te begrijpen en hoe deze samenstelling verandert na behandelingen. Deze tests laten echter niet noodzakelijkerwijs zien welke eiwitten actief of relevant zijn voor tumorprogressie, of stellen clinici in staat niet-invasief de voortgang van de ziekte of de reactie op de behandeling te volgen. Een eiwit kan bijvoorbeeld als omstander aanwezig zijn in een kankercel, maar niet als een actieve deelnemer aan zijn cellulaire transformaties. Enzymen, die biochemische reacties in cellen katalyseren, kunnen een duidelijker beeld geven van welke genen of eiwitten op een bepaald moment moeten worden getarget.
In werk onlangs gepubliceerd in Natuurcommunicatiehebben onderzoekers van het MIT Koch Institute for Integrative Cancer Research een reeks enzymgerichte nanoschaalhulpmiddelen ontwikkeld om kankerprogressie en behandelingsrespons in realtime te volgen, enzymactiviteit in kaart te brengen op precieze locaties in een tumor en relevante celpopulaties te isoleren voor analyse.
“We hopen dat deze nieuwe reeks hulpmiddelen zowel in de kliniek als in het laboratorium nuttig kan zijn”, zegt Sangeeta Bhatia, de John J. en Dorothy Wilson hoogleraar gezondheidswetenschappen en technologie, hoogleraar elektrotechniek, computerwetenschappen en senior auteur van de studie. “Met verdere ontwikkeling kunnen de nanosensoren door clinici worden gebruikt om behandelingen aan te passen aan de specifieke kanker van een patiënt en om de voortgang van kanker en de behandelingsrespons te volgen, terwijl onderzoekers ze kunnen gebruiken om de moleculaire biologie van kanker beter te begrijpen en nieuwe hulpmiddelen te ontwikkelen om te diagnosticeren, spoor en behandel de ziekte.”
Bhatia is ook lid van MIT’s Koch Institute for Integrative Cancer Research en Institute for Medical Engineering and Science. De studie, uitgevoerd in samenwerking met het laboratorium van Tyler Jacks, werd geleid door Ava Amini (Soleimany), een voormalige afgestudeerde student van het Bhatia-laboratorium; en postdoc Jesse Kirkpatrick, ook van het Bhatia-lab.
Tumoren in realtime volgen
Sinds enkele jaren ontwikkelt het laboratorium in Bhatia niet-invasieve urinetests voor de detectie van kanker, waaronder colon-, eierstok- en longkanker. De tests zijn gebaseerd op nanodeeltjes die interageren met tumoreiwitten die proteasen worden genoemd. Proteasen zijn een soort enzym dat fungeert als moleculaire scharen om eiwitten te splitsen en op te splitsen in kleinere componenten. Proteasen helpen kankercellen aan tumoren te ontsnappen door door het extracellulaire netwerk van eiwitten te snijden dat cellen op hun plaats houdt.
De nanodeeltjes zijn gecoat met peptiden (korte eiwitfragmenten) die zich richten op kankergebonden proteasen. Wanneer de nanodeeltjes op de tumorplaats aankomen, worden de peptiden gesneden en komen biomarkers vrij die in de urine kunnen worden gedetecteerd.
In de huidige studie testten de onderzoekers of ze deze technologie niet alleen konden gebruiken om kanker op te sporen, maar ook om de ontwikkeling van kanker en de reactie op behandelingen nauwkeurig en gevoelig in de tijd te volgen. Het team creëerde een panel van 14 nanodeeltjes die zijn ontworpen om zich te richten op proteasen die tot overexpressie worden gebracht in niet-kleincellige longkanker, geïnduceerd in een muismodel. Deze nanodeeltjes waren aangepast om peptiden met streepjescode vrij te geven wanneer ze ontregelde enzymen tegenkomen in de micro-omgeving van de tumor.
Elke nanosensor was in staat om verschillende patronen van protease-activiteit te volgen, die drastisch veranderden naarmate de tumor vorderde. Na behandeling met een op longkanker gericht medicijn, konden de onderzoekers snel tekenen van tumorregressie vinden, binnen slechts drie dagen na toediening van de behandeling.
Celkaarten en populaties
Hoewel de bestaande nanosensortechniek zou kunnen worden gebruikt om tumorprogressie en behandelingsrespons in het algemeen te volgen, kan deze op zichzelf geen licht werpen op het specifieke cellulaire proces dat aan het werk is.
“Zoals veel van de beschikbare hulpmiddelen om moleculaire markers voor kanker te beoordelen, behandelt onze urinereporter het lichaam als een zwarte doos”, zegt Kirkpatrick. “Terwijl we wat informatie krijgen over de toestand van de ziekte, wilden we meer weten over de cellen of eiwitten die ervoor zorgen dat de ziekte zich op een bepaalde manier gedraagt.”
Nadat ze interessante nanosensoren hadden geïdentificeerd, brachten onderzoekers in kaart waar in de micro-omgeving van de tumor de enzymen die op deze sensoren inwerkten, actief waren. Ze hebben hun nanosondes aangepast om fluorescerende tags achter te laten wanneer ze van de nanosensor worden gesplitst, waarbij ze verschillende tags aan verschillende proteasen toewijzen. Nadat ze de nanosondes op longweefselmonsters hadden aangebracht, zochten ze naar patronen in hoe de tags werden verdeeld.
Eén tag resulteerde in een merkwaardig spoelachtig patroon dat bleek te behoren tot het tumorvasculatuur. Onderzoekers hebben de protease-activiteit vastgesteld op specifieke soorten cellen: endotheelcellen, die de bloedvaten bekleden, en pericyten, die de vasculaire functie reguleren en actief worden gerekruteerd in angiogenese – een van de archetypische kenmerken van de groei van kankercellen. Angiogenese stelt tumorcellen in staat om bestaande bloedvaten te rekruteren en nieuwe te stimuleren om zich te vormen, om de voedingsstoffen te verkrijgen die nodig zijn voor tumorvorming en -progressie.
Met behulp van hun nanosondes om cellen te labelen en te sorteren op basis van hun enzymatische activiteit, identificeerde het team populaties van cellen geassocieerd met vasculatuur die verhoogde expressie vertoonden van genen gerelateerd aan angiogenese. De onderzoekers vonden ook aanwijzingen voor signalering tussen pericyten en de endotheelcellen die samen angiogene bloedvaten in vaatweefsel vormen.
Kenmerkende waarnemingen
In toekomstig werk wil het team de specifieke protease identificeren die actief is in pericyten en zijn rol in angiogenese ontleden. Met deze kennis hopen ze formuleringen van therapieën te ontwikkelen die aan patiënten kunnen worden geleverd om de rekrutering en vorming van bloedvaten die verband houden met tumorgroei te verstoren.
Uiteindelijk voorziet het team echter panelen van nanosondes die zich richten op verschillende belangrijke kenmerken van kanker, gelijktijdig en niet-invasief bij patiënten. Andere kenmerken van kanker zijn onder meer proliferatieve signalering, het ontwijken van groeionderdrukkers, genoominstabiliteit, weerstand tegen celdood, gedereguleerd metabolisme en activering van invasie en metastase. Omdat kanker de protease-activiteit in al deze processen verandert, zouden de nanoprobes van het team kunnen worden ontworpen om zich op deze verschillende processen te richten, met als doel een uitgebreid beeld te geven van de tumoractiviteit die de ziekte veroorzaakt. De aanpak kan worden gebruikt door onderzoekers die belangrijke biologische fenomenen in kankermodellen willen onderzoeken, evenals door clinici die de progressie van kanker niet-invasief willen volgen en behandelingen voor hun patiënten willen selecteren.
Meer informatie:
Ava P. Amini et al, Multiscale profilering van protease-activiteit bij kanker, Natuurcommunicatie (2022). DOI: 10.1038/s41467-022-32988-5
Journaal informatie:
Natuurcommunicatie