Polymere ionverbindingen kunnen zich binden aan plasmide-DNA om een geneesmiddelafgiftevoertuig te vormen voor intramusculaire injectie. Het team ontdekte dat hun nieuwe verbinding effectieve afgifte van pDNA over grote gebieden laat zien wanneer het in muizen wordt geïnjecteerd. Credit: Tokyo Metropolitan University
Onderzoekers van de Tokyo Metropolitan University hebben een nieuw medicijn-afgiftemolecuul gecreëerd, een zwitterionisch polymeercomplex dat kan helpen om plasmide-DNA in cellen te krijgen wanneer het in skeletspieren wordt geïnjecteerd, een cruciale stap in de expressie van therapeutische RNA en eiwitten. De studie is gepubliceerd in het dagboek Biomaterialenwetenschap.
De nieuwe verbinding is effectief gebonden aan plasmide-DNA zonder de structuur ervan te beïnvloeden. Geïnjecteerd in muizenspieren, observeerde het team wijdverspreide genexpressie.
Systemen voor medicijnafgifte liggen ten grondslag aan veel van de klinische doorbraken van onze tijd. Het COVID-19-vaccin gebruikt bijvoorbeeld lipidenanodeeltjes om messenger RNA (mRNA) te omhullen en ze via een proces genaamd endocytose naar cellen te brengen; eenmaal binnen wordt mRNA vrijgegeven via “endosomale ontsnapping” voordat het door cellulaire machines wordt “vertaald” in antigenen die een immuunreactie uitlokken.
Maar hoewel dergelijke methoden succesvol zijn gebruikt, zijn er nog steeds uitdagingen die overwonnen moeten worden, zoals ongewenste aggregatie van de drager. Naarmate behandelingen diverser worden, zijn onderzoekers op zoek naar nieuwe toedieningsmethoden voor een breder scala aan toepassingen.
Een team van de Tokyo Metropolitan University onder leiding van professor Shoichiro Asayama onderzoekt het gebruik van polyionen, polymeren met een elektrische lading, om plasmide-DNA (pDNA) in cellen te transporteren.
Plasmide-DNA kan worden getranscribeerd naar messenger-RNA of worden vertaald naar eiwitten, wat ze een veelzijdig voertuig voor therapieën maakt. Het zijn ook negatief geladen polymeren die kunnen binden aan positief geladen polyionen.
Het is echter verre van ideaal om simpelweg een groot, positief geladen polymeer te maken, omdat hun lading ze giftig kan maken voor cellen. Recente pogingen zijn gericht op zwitterionen, dat wil zeggen verbindingen met een positieve lading op het ene deel en een negatieve lading op het andere.
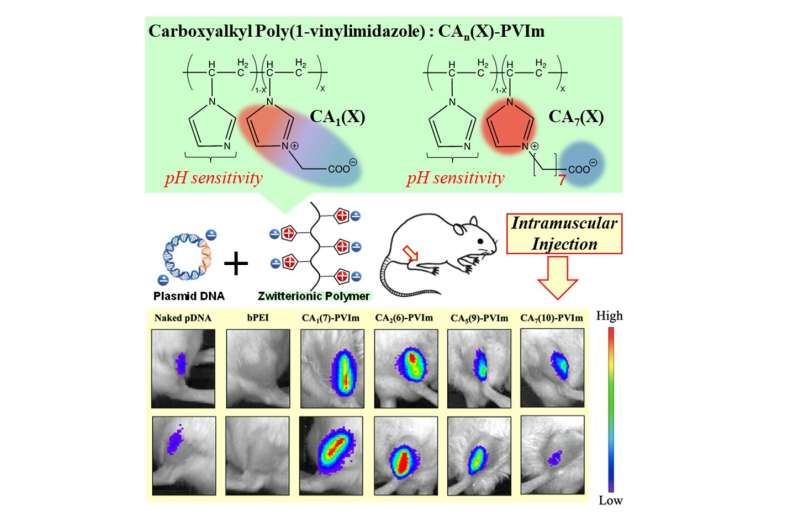
Nu heeft het team de eerste zwitterionische polymeerverbinding (CA-PVIm) ontwikkeld met een imidazoliumkation (positieve lading) dat een complex kan vormen met pDNA.
Imidazoliumgroepen hebben het voordeel dat ze een positieve lading hebben die over een ring van atomen is uitgesmeerd, waardoor ze een goede kans hebben om sterk te binden aan pDNA. Negatief geladen delen waren samengesteld uit carboxylgroepen die door een korte koolwaterstofketen van elkaar gescheiden waren; deze werden in verschillende verhoudingen aan de polymeerketen toegevoegd.
In voorlopige experimenten ontdekten ze dat hun nieuwe verbinding een laag gebonden watermoleculen in oplossing had, wat ze bioinert zou kunnen maken. Gemengd met pDNA, een methode die wordt gebruikt om DNA-verbindingen op lengte te scheiden, werd gebruikt om aan te tonen dat pDNA succesvol kan complexeren met CA-PVIm. Andere metingen toonden ook aan dat de complexe hiërarchische structuur van het pDNA behouden bleef.
Het team testte hun samenstelling door deze in het spierweefsel van muizen te injecteren. Vergeleken met kale pDNA vonden ze genexpressie door de pDNA over een drastisch groter gebied.
Dit toonde duidelijk aan dat hun polyion werd opgenomen in cellen en endosomale ontsnapping onderging. Ze identificeerden ook een optimale verbinding, met 7% van de beschikbare sites met negatieve ladingen (CA(7)-PVIm), die het grootste effect gaf.
Omdat het zijn vracht over grote spiermassa’s kan vervoeren, beloven de bevindingen van het team nieuwe therapieën voor ernstige spierziekten.
Meer informatie:
Ren Misaizu et al, Diffuse afgifte van plasmide-DNA met behulp van zwitterionische carboxyalkylpoly(1-vinylimidazole) in skeletspieren in vivo, Biomaterialenwetenschap (2024). DOI-nummer: 10.1039/D4BM00510D
Informatie over het tijdschrift:
Biomaterialenwetenschap
Aangeboden door Tokyo Metropolitan University