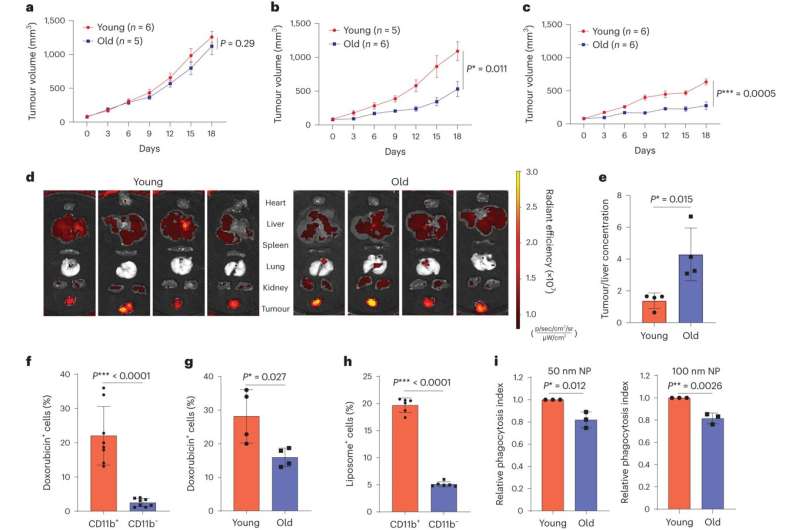
Leeftijdsverschillen in de effectiviteit van nanogeneeskunde bij kanker. a – c, groeicurven van E0771-borsttumorcellen geïmplanteerd in jonge of oude C57BL6-muizen behandeld met zoutoplossing (controle) (a), nab-paclitaxel (b) of liposomaal doxorubicine (c). Tumorvolumes op dag 18 werden vergeleken. d, IVIS-beelden van hart, lever, milt, long, nier en tumor 2 uur na toediening van liposomale doxorubicine. e, Kwantificering van relatieve tumor-/leverdoxorubicineconcentraties. De verhouding van de relatieve concentratie werd berekend aan de hand van de totale emissie, genormaliseerd op basis van het orgaangewicht. n = 4 muizen in elke groep. f, Kwantificering van doxorubicine+ percentages in de CD11b+ en CD11b-levercelpopulaties. n = 8 muizen. g, Percentage lever-CD11b+ cellen van jonge of oude muizen met een positief doxorubicinesignaal gedetecteerd door flowcytometrie. n = 4 muizen in elke leeftijdsgroep. h, Samengevat resultaat van het percentage CD11b+ en CD11b-levercellen met liposoomopname. n = 6 muizen. i, Fagocytose van nanodeeltjes door oude en jonge lever CD11b+ cellen. n = 3 muizen in elke groep. Tweezijdige ongepaarde t-toetsen werden gebruikt in a – c en e – i. Foutbalken zijn gemiddelden ± sem in a – c. Foutbalken zijn gemiddelden ± sd in e – i. In de figuur zijn enkele n-waarden vermeld, waarbij n het aantal biologisch onafhankelijke muizen aangeeft. Credit: Natuur Nanotechnologie (2023). DOI: 10.1038/s41565-023-01502-3. https://www.nature.com/articles/s41565-023-01502-3
Onderzoekers van het MD Anderson Cancer Center van de Universiteit van Texas hebben ontdekt dat bepaalde op nano gebaseerde kankertherapieën mogelijk minder effectief zijn bij jongere patiënten, wat de noodzaak benadrukt van verder onderzoek naar de impact van veroudering op het vermogen van het lichaam om op de behandeling te reageren.
De onderzoekers ontdekten dat leeftijdsgebonden verschillen te wijten zijn aan hoe effectief de lever de bloedbaan filtert. Jongere levers zijn efficiënter in dit proces, waardoor de gifstoffen in het bloed worden beperkt, maar ook nuttige behandelingen worden weggefilterd, waardoor deze mogelijk ineffectief worden.
De studie, gepubliceerd op 18 september in Natuur Nanotechnologiewerd geleid door Wen Jiang, MD, Ph.D., universitair hoofddocent Radiotherapie, en Betty Kim, MD, Ph.D., hoogleraar Neurochirurgie.
“Simpel gezegd: onze lever is ontworpen om ons te beschermen, maar voor jonge mensen kan het hen ook beschermen op een manier die de effectiviteit van nanotherapieën beperkt,” zei Jiang.
“Er is momenteel zoveel belangstelling voor toedieningssystemen en -ontwerpen op nanoschaal, maar niemand heeft er echt over nagedacht hoe leeftijd een rol speelt in de effectiviteit van deze systemen. In preklinische modellen werken jongere levers zelfs zo goed dat ze een aanzienlijk deel eruit filteren.” van de nanogeneeskunde. Dat betekent dat deze medicijnen in sommige gevallen mogelijk minder effectief zijn bij jongere patiënten dan bij oudere patiënten.”
In tegenstelling tot traditionele kankertherapieën, waarbij medicijnen rechtstreeks in het lichaam worden geïntroduceerd, gebruiken nanomedicijnen dragers op nanoschaal om behandelingen te leveren. Enkele van de voordelen van nanogeneesmiddelformuleringen kunnen verminderde toxiciteit, verhoogde doelspecificiteit en verhoogde dosering omvatten, afhankelijk van het doel van de behandeling.
Tot op heden zijn meer dan 50 nanogebaseerde therapieën goedgekeurd door de Food and Drug Administration, waaronder 19 die momenteel door het National Cancer Institute zijn vermeld voor gebruik bij kanker. De onderzoeksbehandeling was aan nanodeeltjes-albumine gebonden paclitaxel, dat sinds 2005 wordt gebruikt voor bepaalde refractaire of recidiverende kankers.
Wetenschappers begrijpen niet volledig alle mechanismen die bepalen hoe de lever de bloedbaan precies filtert, maar eerdere onderzoeken hebben een verband aangetoond tussen de klaringssnelheid en de expressie van de aaseterreceptor MARCO. Dit eiwit komt meer tot expressie in jongere Kupfer-cellen, de immuuncellen die zich in de lever bevinden.
Na bevestiging van de ongelijkheid in resultaten tussen jonge en oude modellen, onderzocht het team de therapeutische blokkade van MARCO als een mogelijke strategie om de klaring van geneesmiddelen te voorkomen. Het blokkeren van MARCO verminderde de opname van het nanogeneesmiddel en verbeterde de antitumorale effecten van het medicijn tegen kanker, maar alleen in de jongere modellen.
“Dit is slechts één voorbeeld, maar deze resultaten laten zien dat er niet altijd een one-size-fits-all strategie voor medicijntoediening bestaat die effectief is bij diverse patiëntenpopulaties, en dat gepersonaliseerd ontwerp gerechtvaardigd is in toekomstige nanogeneesmiddelen,” zei Jiang. “Hopelijk opent deze studie ook de deur voor een grondiger onderzoek naar het goedkeuringsproces en hoe dit te overwinnen.”
Jiang benadrukte dat hoewel deze studie zich richt op kanker, het een potentiële hindernis onderzoekt voor elk systeem voor de toediening van nanomedicijnen. Er zijn verschillende eiwitten, antilichamen en virussen met unieke klaringsmechanismen, maar het komt allemaal neer op de lever, legde hij uit.
Meer informatie:
Wen Jiang et al., Leeftijdsgebonden ongelijkheid in fagocytische klaring beïnvloedt de werkzaamheid van nanotherapeutica tegen kanker, Natuur Nanotechnologie (2023). DOI: 10.1038/s41565-023-01502-3. www.nature.com/articles/s41565-023-01502-3
Tijdschriftinformatie:
Natuur Nanotechnologie
Aangeboden door het MD Anderson Cancer Center van de Universiteit van Texas