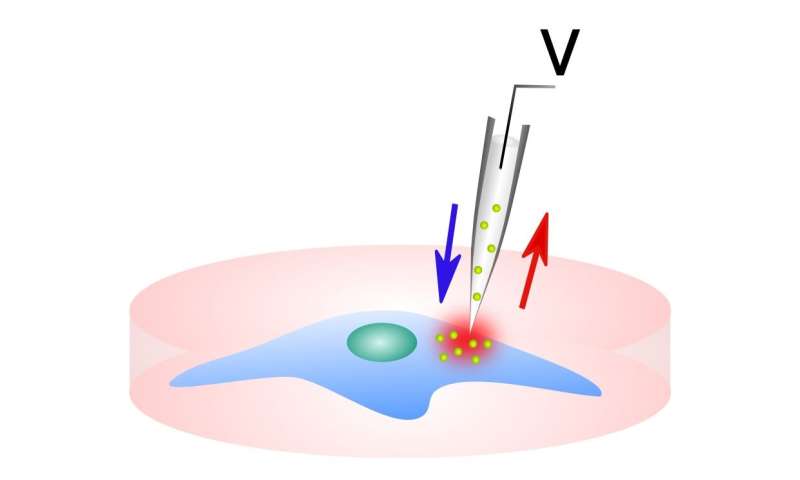
Deze afbeelding toont het aflever- / bemonsteringssysteem. Krediet: Northwestern McCormick School of Engineering
Cellijnen geïnjecteerd met vrij nucleïnezuur worden veel gebruikt voor het ontdekken van geneesmiddelen en het modelleren van ziekten. Om genetisch gemengde celpopulaties te vermijden, gebruiken onderzoekers verdunningstechnieken om afzonderlijke cellen te selecteren die vervolgens identieke lijnen zullen genereren. De route van het beperken van verdunningen is echter vervelend en tijdrovend.
Een nieuwe studie door Noordwestelijke onderzoekers laat zien hoe Nanofountain Probe Electroporation (NFP-E), een hulpmiddel dat moleculen in enkele cellen levert, dat probleem zou kunnen oplossen en zou kunnen leiden tot nieuwe toepassingen voor het screenen van geneesmiddelen en het ontwerpen van patiëntspecifieke behandelingskuren.
Het team, geleid door Horacio Espinosa van Northwestern Engineering en inclusief Joshua Leonard, demonstreert de veelzijdigheid van NFP-E – dat DNA of RNA in cellen introduceert met behulp van elektriciteit. Het kan ook zowel eiwitten als plasmiden afleveren in een verscheidenheid aan dierlijke en menselijke celtypen met dosiscontrole. Het team bestond uit John Kessler, de Ken en Ruth Davee hoogleraar stamcelbiologie en hoogleraar neurologie en farmacologie aan de Northwestern University Feinberg School of Medicine.
De nieuwe methode kan worden gebruikt om ziekte te bestuderen of voor celtherapie. In het eerste geval wordt het genoom gemanipuleerd. In het laatste geval vindt gen-bewerking plaats in cellen zoals T-cellen om kanker te behandelen met immunotherapieën.
Door gebruik te maken van eencellige elektroporatie, het proces waarbij DNA of RNA in afzonderlijke cellen wordt geïntroduceerd met behulp van een elektrische puls, die de poriën in het celmembraan kort opent, laat hun werk zien hoe NFP-E een fijne controle verkrijgt over de relatieve expressie van twee co- getransfecteerde plasmiden. Bovendien, door eencellige elektroporatie te combineren met time-lapse fluorescerende beeldvorming, onthult hun onderzoek karakteristieke tijden voor elektro-poriënsluiting.
De bemonstering vóór elektroporatie. Krediet: Northwestern McCormick School of Engineering
“We hebben het potentieel van de NFP-E-technologie aangetoond bij het manipuleren van een verscheidenheid aan celtypen met stoichiometrische controle van moleculaire lading die kan worden gebruikt voor het uitvoeren van een breed scala aan onderzoeken naar het screenen van geneesmiddelen, celtherapieën en synthetische biologie,” zei Espinosa, James N. en Nancy J. Farley hoogleraar fabricage en ondernemerschap en hoogleraar werktuigbouwkunde en (met dank) biomedische techniek en civiele techniek en milieutechniek.
Momenteel kunnen biomoleculen op verschillende manieren in cellen worden afgeleverd: virale vectoren; chemische dragers, zoals celpenetrerende peptiden en polymeer nanocapsules; lipofectamine en bulkelektroporatie.
“Er bestaan een aantal strategieën om biomoleculen in cellen af te leveren, maar elk heeft zijn beperkingen”, zegt Leonard, universitair hoofddocent chemische en biologische technologie en Charles Deering McCormick hoogleraar Teaching Excellence. “Chemische dragers zorgen bijvoorbeeld voor een relatief langzame afgifte en kunnen giftig zijn voor de cel; virale vectoren zijn vaak efficiënt, maar kunnen ongunstige immuunresponsen en genotoxiciteit van de insertie veroorzaken. Het gebruik van een traditionele methode vereist vaak aanzienlijke inspanningen om het protocol te optimaliseren, afhankelijk van de cel. type en af te leveren molecuul, en daarom zou een gemakkelijk generaliseerbare afleveringsstrategie voor biomoleculen enkele zinvolle voordelen bieden. “
Het nieuwe NFP-E-systeem maakt eencellige levering van DNA, RNA en eiwitten in verschillende onsterfelijk gemaakte cellijnen mogelijk, evenals primaire cellen met meer dan 95 procent efficiëntie en meer dan 90 procent levensvatbaarheid van de cellen.
“De resultaten geven aan dat de hersluitbare tijd van het celmembraan niet-lineair schaalt met de pulsspanning en het aantal elektroporatiepulsen, waarbij een maximum wordt bereikt bij tussenliggende waarden,” zei Espinosa. “Dat betekent dat lange pulstijden of hoge spanningen niet nodig lijken te zijn voor efficiënt moleculair transport door celmembranen. Dat kenmerk is belangrijk voor het verkrijgen van een hoge transportefficiëntie terwijl de celtoxiciteit tot een minimum wordt beperkt.”
De bemonstering na elektroporatie. Krediet: Northwestern McCormick School of Engineering
Met behulp van eencellige elektroporatietechnologie waren de onderzoekers in staat de transportmechanismen te begrijpen die betrokken zijn bij gelokaliseerde op elektroporatie gebaseerde celbemonstering. Een obstakel voor niet-destructieve tijdelijke eencellige bemonstering zijn de kleine hoeveelheden cytosol – de vloeistof in cellen – die worden geëxtraheerd, waardoor het moeilijk is om RNA-sequenties of eiwitten te testen of te detecteren.
Onderzoek toonde aan dat de schaalvergroting van de hersluittijd van het membraan een functie is van verschillende elektroporatieparameters, waardoor inzicht wordt verkregen in de dynamiek van de elektroporiën na de puls.
“Het werk richt zich op de noodzaak om manieren te begrijpen om de door cytosol bemonsterde hoeveelheid te verhogen, zonder de cellen nadelig te beïnvloeden”, zei Espinosa. “Dat kan de onderzoeksgemeenschap begeleiden bij het ontwerpen van experimenten gericht op elektroporatie-gebaseerde bemonstering van intracellulaire moleculen voor temporele celanalyse.”
Dit onderzoek is gerelateerd aan eerder werk dat een minimaal invasieve methode ontwikkelde om cellen te bemonsteren die meerdere keren kan worden herhaald. Dat eerdere onderzoek, waarbij elektrische pulsen werden gebruikt om enzymen uit het cytosol te extraheren, hielp het begrip van de kinetiek van poriënvorming en sluiting.
Het artikel “Nanofountain Probe Electroporation Maakt Veelzijdige Eencellige Intracellulaire Levering en Onderzoek naar Postpulse Electropore Dynamics” werd op 2 oktober gepubliceerd in het tijdschrift Klein.
Klein
Geleverd door Northwestern University