Grafisch abstract. Credit: Nano-letters (2022). DOI: 10.1021/acs.nanolet.2c02232
Mechanica speelt een fundamentele rol in de celbiologie. Cellen navigeren door deze mechanische krachten om hun omgeving te verkennen en het gedrag van omringende levende cellen te voelen. De fysieke kenmerken van de omgeving van een cel hebben op hun beurt invloed op de celfuncties. Daarom biedt inzicht in hoe cellen omgaan met hun omgeving cruciale inzichten in celbiologie en heeft het bredere implicaties in de geneeskunde, waaronder ziektediagnose en kankertherapie.
Tot nu toe hebben onderzoekers talloze tools ontwikkeld om het samenspel tussen cellen en hun 3D-micro-omgeving te bestuderen. Een van de meest populaire technologieën is tractiekrachtmicroscopie (TFM). Het is een toonaangevende methode om de tracties op het substraatoppervlak van een cel te bepalen en biedt belangrijke informatie over hoe cellen de krachten voelen, aanpassen en erop reageren.
De toepassing van TFM is echter beperkt tot het verstrekken van informatie over de translatiebeweging van markers op celsubstraten. Informatie over andere vrijheidsgraden, zoals rotatiebewegingen, blijft speculatief vanwege technische beperkingen en beperkt onderzoek over het onderwerp.
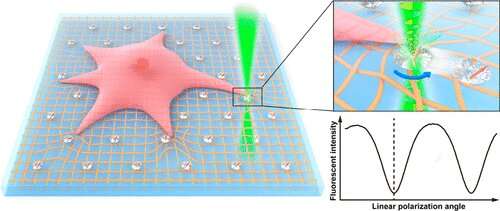
Technische experts van de Universiteit van Hong Kong hebben een nieuwe techniek voorgesteld om het krachtveld van de celtractie te meten en de onderzoekskloof aan te pakken. Het interdisciplinaire onderzoeksteam werd geleid door Dr. Zhiqin Chu van de afdeling Electrical and Electronic Engineering en Dr. Yuan Lin van de afdeling Werktuigbouwkunde. Ze gebruikten enkele stikstof-vacature (NV) centra in nanodiamanten (ND’s) om een lineaire polarisatiemodulatie (LPM) -methode voor te stellen die zowel de rotatie- als de translatiebeweging van markers op celsubstraten kan meten.
De studie biedt een nieuw perspectief op de meting van het multidimensionale celtractiekrachtveld en de resultaten zijn gepubliceerd in het tijdschrift Nano-letters.
Het onderzoek toonde zeer nauwkeurige metingen van de rotatie- en translatiebeweging van de markers op het celsubstraatoppervlak. Deze experimentele resultaten bevestigen de theoretische berekeningen en eerdere resultaten.
Gezien hun ultrahoge fotostabiliteit, goede biocompatibiliteit en gemakkelijke chemische oppervlaktemodificatie, zijn fluorescerende ND’s met NV-centra uitstekende fluorescerende markers voor veel biologische toepassingen. De onderzoekers ontdekten dat op basis van de meetresultaten van de relatie tussen de fluorescentie-intensiteit en de oriëntatie van een enkel NV-centrum in de richting van de laserpolarisatie, zeer nauwkeurige oriëntatiemetingen en achtergrondvrije beeldvorming konden worden bereikt.
Zo helpt de door het team uitgevonden LPM-methode bij het oplossen van technische knelpunten in cellulaire krachtmeting in de mechanobiologie, die interdisciplinaire samenwerkingen omvat van biologie, techniek, scheikunde en natuurkunde.
“De meeste cellen in meercellige organismen ervaren krachten die sterk georkestreerd zijn in ruimte en tijd. De ontwikkeling van een multidimensionale celtractiekrachtveldmicroscopie is een van de grootste uitdagingen in het veld geweest,” zei Dr. Chu.
“Vergeleken met de conventionele TFM biedt deze nieuwe technologie ons een nieuw en handig hulpmiddel om de echte 3D-cel-extracellulaire matrixinteractie te onderzoeken. Het helpt bij het verkrijgen van zowel rotatie-translationele bewegingsmetingen in het cellulaire tractieveld als informatie over de celtractie onthult kracht”, voegde hij eraan toe.
Het belangrijkste hoogtepunt van de studie is de mogelijkheid om zowel de translatie- als de rotatiebeweging van markers met hoge precisie aan te geven. Het is een grote stap in de richting van het analyseren van mechanische interacties aan de cel-matrix-interface. Het biedt ook nieuwe onderzoeksrichtingen.
Door gespecialiseerde chemicaliën op het celoppervlak werken cellen samen en verbinden ze zich als onderdeel van een proces dat celadhesie wordt genoemd. De manier waarop een cel spanning genereert tijdens adhesie is voornamelijk beschreven als ‘in-plan’. Processen zoals tractiestress, actinestroom en adhesiegroei zijn allemaal met elkaar verbonden en vertonen een complexe directionele dynamiek.
De LPM-methode zou kunnen helpen om de gecompliceerde torsie rond focale adhesie te begrijpen en verschillende mechanische belastingen op nanoschaalniveau te scheiden (bijvoorbeeld normale tracties, afschuifkrachten). Het kan ook helpen begrijpen hoe celadhesie reageert op verschillende soorten stress en hoe deze mechanotransductie bemiddelen (het mechanisme waardoor cellen mechanische prikkels omzetten in elektrochemische activiteit).
Deze technologie is ook veelbelovend voor de studie van verschillende andere biomechanische processen, waaronder activering van immuuncellen, weefselvorming en de replicatie en invasie van kankercellen. T-celreceptoren, die een centrale rol spelen bij immuunresponsen op kanker, kunnen bijvoorbeeld extreem dynamische krachten genereren die essentieel zijn voor weefselgroei. Deze uiterst nauwkeurige LPM-technologie kan helpen deze multidimensionale krachtdynamiek te analyseren en inzicht te geven in weefselontwikkeling.
Het onderzoeksteam doet actief onderzoek naar methoden om optische beeldvormingsmogelijkheden uit te breiden en tegelijkertijd meerdere nanodiamanten in kaart te brengen.
Lingzhi Wang et al, All-Optical Modulation of Single Defects in Nanodiamonds: onthulling van rotatie- en translatiebewegingen in celtractiekrachtvelden, Nano-letters (2022). DOI: 10.1021/acs.nanolet.2c02232
Nano-letters
Geleverd door de Universiteit van Hong Kong