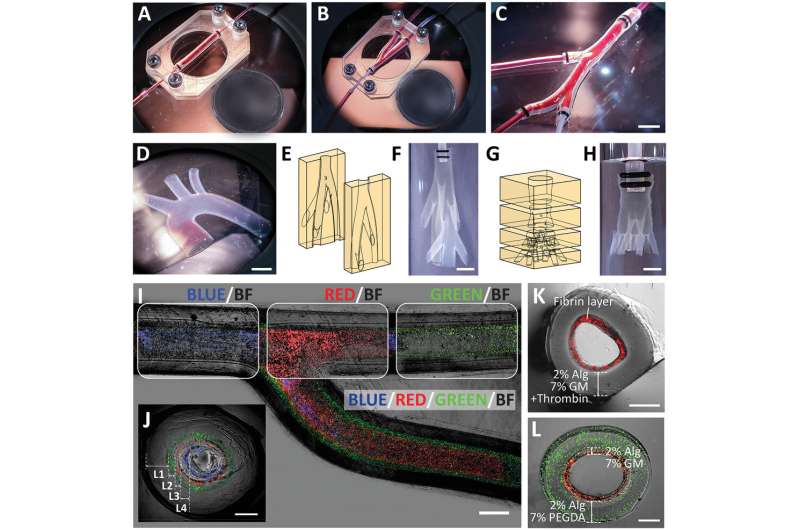
Planaire vasculaire modellen: A) rechte vasculaire constructie, B) vertakkende vasculaire constructie, C) vasculaire constructies met meerdere takken, en D) aortaboog. Illustraties en foto’s van 3D-vasculaire modellen: E,F) een niet-planair biomimetisch vertakkingsnetwerk (één inlaat tot zeven takken), G,H) een niet-vlakke vasculaire boom (één inlaat tot negen takken). Afbeelding van een vertakkende vasculaire constructie bestaande uit vier lagen (zoals afgebeeld door de ingekapselde fluorescerende kralen van verschillende kleuren) weergegeven in I) bovenaanzicht en J) dwarsdoorsnede. Dwarsdoorsnede beeld van meerlagige vasculaire constructie bestaande uit K) Alg-GM in de buitenste laag en fibrinehydrogel in de binnenste laag, en L) Alg-PEGDA in de buitenste laag en Alg-GM in de binnenste laag. Schaalbalken: (I) 1 mm, (C,D,F,H) 5 mm, (J–L) 500 µm. Cirkelreferentie (diameter): A, B) 18,50 mm. Krediet: SUTD
Hart- en vaatziekten (HVZ) blijven wereldwijd een van de belangrijkste doodsoorzaken. Er is dringend behoefte aan verbeterde vasculaire modellen, anatomisch en biologisch, om ons begrip van ziekteprogressie te vergroten. Een dergelijk begrip kan leiden tot de ontwikkeling van nieuwe therapeutische interventies.
Hoewel wetenschappers conventioneel sterk afhankelijk zijn van diermodellen om licht te werpen op de pathofysiologie van hart- en vaatziekten en de ontwikkeling van geneesmiddelen, worden ze beperkt door hun vermogen om toxiciteit bij mensen te voorspellen. “Gezien de verschillen in de onderliggende moleculaire, cellulaire en fysiologische mechanismen tussen dieren en mensen, bieden diermodellen ons niet noodzakelijkerwijs een nauwkeurig begrip van de menselijke fysiologie”, legt universitair hoofddocent Yi-Chin Toh uit, corresponderend auteur van de Queensland University of Technology ( QUOT).
Om alternatieve modellen te creëren die relevanter zijn voor de mens, wenden wetenschappers zich tot technische weefsels met behulp van levende menselijke cellen. “Om de belangrijkste cellulaire en moleculaire bijdragen aan de menselijke fysiologie en pathofysiologie te identificeren, worden levende menselijke cellen gebruikt op het gebied van weefseltechnologie om kunstmatige modellen te bouwen met een gedefinieerde samenstelling op cel-, weefsel- en orgaanniveau”, legt professor Toh uit.
Door rechtstreeks gebruik te maken van menselijke cellen, zouden deze gemanipuleerde weefsels inzicht kunnen verschaffen in de normale functie van menselijke organen en pathofysiologie van de ziekte, en ook de veiligheid en werkzaamheid van onderzoekstherapieën bij mensen nauwkeuriger kunnen voorspellen.
Een van de technologieën die momenteel worden gebruikt op het gebied van weefseltechnologie is 3D-bioprinting, waarbij levende menselijke cellen worden gemengd met bioinkt en op een specifieke manier worden gedeponeerd om de micro-omgeving van inheemse organen te recapituleren. Het fabriceren van de fijne kneepjes die in organen worden aangetroffen met behulp van de huidige bioprintmethoden is echter nog steeds een uitdaging vanwege technologische beperkingen.
Een van de moeilijkheden is het recapituleren van de complexiteit van bloedvaten. Bloedvaten vertakken bijvoorbeeld hiërarchisch, waarbij grotere bloedvaten zich vertakken in meerdere kleinere bloedvaten over verschillende lengteschalen. Bloedvaten zijn ook meerlagig, waarbij elke laag uit verschillende celtypen bestaat.
“De geprinte bioinkt moet een dubbele functie hebben: het ondersteunen van levende cellen en het bieden van structurele integriteit aan het vasculaire construct. Bestaande bioinkten die geschikt zijn voor levende cellen zijn meestal zacht en kwetsbaar, waardoor het een uitdaging is om de complexe architectuur van bloedvaten direct in 3D te printen,” zei hoofdonderzoeker, universitair hoofddocent Michinao Hashimoto van de Singapore University of Technology and Design (SUTD).
“Vanwege de bestaande beperkingen van 3D-bioprinting, hebben we besloten af te wijken van het volledig vertrouwen op 3D-printen om de vasculaire constructies te fabriceren.”
Het team ontwikkelde een fabricagetechniek geïnspireerd op de eeuwenoude vormmethode. 3D-printen werd gebruikt om de mallen voor de vasculaire netwerken te fabriceren. In tegenstelling tot conventionele vormprocessen waarbij het gevulde vloeibare materiaal massaal stolt, introduceerde het team een unieke stollingsbenadering.
De techniek omvatte het gebruik van een tweedelige, 3D-geprinte mal bestaande uit hydrogels van poly (ethyleenglycol) diacrylaat (PEGDA). PEGDA-hydrogel werd gekozen omdat het zich als een spons zou kunnen gedragen om calciumionen op te nemen, die verantwoordelijk zijn voor het verknopen van de geselecteerde bioinkt.
Toen de alginaathoudende bioinkt door de vormholte werd geperfuseerd, diffundeerden de calciumionen in de vorm radiaal in de vormholte. De diffusie van de calciumionen veroorzaakte een snelle ionische verknoping van het alginaat dat aanwezig is in de bioink, waardoor een buisvormig construct werd gevormd.
“We kunnen de dikte van de vaatwand effectief controleren door de tijdsduur dat de bioinkt in de vormholte wordt gehouden te variëren. Vervolgens kunnen we een bufferoplossing door de mal perfuseren om de niet-verknoopte bioinkt te verwijderen”, zegt hoofdauteur Terry Ching, Ph. D. student van SUTD.
Met behulp van deze techniek hebben de onderzoekers met succes vrijstaande, vertakte, meerlagige en perfuseerbare vasculaire netwerken ontwikkeld. “Belangrijk is dat we andere bioactieve materialen in de bioinkt konden mengen om de micro-omgeving geschikter te maken voor menselijke vasculaire cellen,” voegde Ching eraan toe.
Het team nam relevante vasculaire cellen op in een configuratie die vergelijkbaar is met die in vivo. Het team monteerde ook hun vrijstaande vasculaire constructies op een uitzetbare ballon om de cyclische belasting te simuleren die kransslagaders in vivo ervaren.
De veelzijdigheid en veelzijdige mogelijkheden van deze fabricagetechniek zouden gebruikers meer controle moeten geven bij het onderbrengen van een verscheidenheid aan bioinks en patiëntspecifieke cellen. “Uiteindelijk hopen we deze biomimetische vasculaire constructies te gebruiken om toekomstig onderzoek naar het mechanistische begrip van CVD’s te bevorderen, evenals modellen om therapeutische interventies te evalueren”, verklaarde universitair hoofddocent Michinao Hashimoto.
Het artikel is gepubliceerd in het tijdschrift Klein.
Meer informatie:
Terry Ching et al, Biomimetic Vasculatures door 3D-gedrukte poreuze mallen (Small 39/2022), Klein (2022). DOI: 10.1002/smll.202270209
Journaal informatie:
Klein
Geleverd door Singapore University of Technology and Design