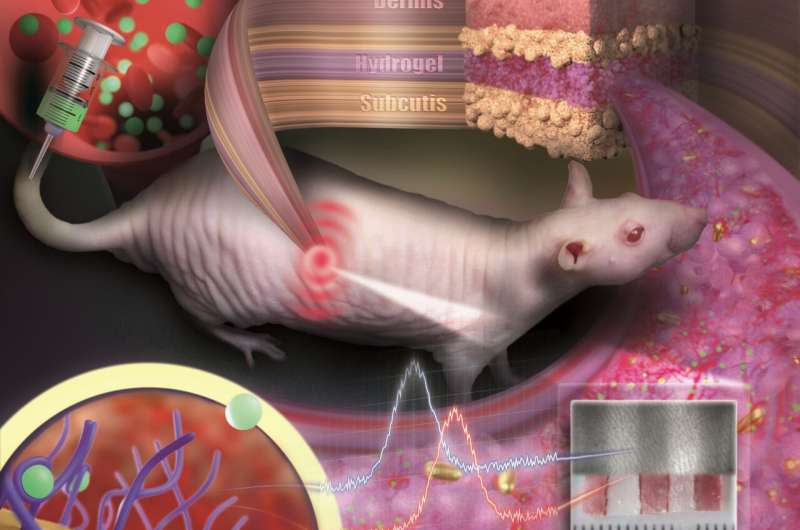
Gouden nanodeeltjes ingebed in een poreuze hydrogel kunnen onder de huid worden geïmplanteerd en als medische sensoren worden gebruikt. De sensor is als een onzichtbare tatoeage die concentratieveranderingen van stoffen in het bloed onthult door kleurverandering. Krediet: Nanobiotechnology Group, JGU Department of Chemistry
Het idee van implanteerbare sensoren die continu informatie uitzenden over vitale waarden en concentraties van stoffen of medicijnen in het lichaam fascineert artsen en wetenschappers al lang. Dergelijke sensoren maken een constante monitoring van ziekteprogressie en therapeutisch succes mogelijk. Tot nu toe waren implanteerbare sensoren echter niet geschikt om permanent in het lichaam te blijven en moeten ze na een paar dagen of weken worden vervangen.
Er is ook het probleem van de afstoting van een implantaat, aangezien het immuunsysteem de sensor als een vreemd voorwerp herkent. Bij veel technologieën is de kleur van de sensor, die concentratieveranderingen aangeeft, onstabiel en vervaagt na verloop van tijd. Wetenschappers van de Johannes Gutenberg Universiteit Mainz (JGU) hebben een nieuw type implanteerbare sensor ontwikkeld die gedurende enkele maanden in het lichaam kan worden geïmplanteerd. De sensor is gebaseerd op kleurstabiele gouden nanodeeltjes die zijn gemodificeerd met receptoren voor specifieke moleculen. Ingebed in een kunstmatig polymeer weefsel, wordt de nanogold onder de huid geïmplanteerd, waar het veranderingen in geneesmiddelconcentraties meldt door de kleur te veranderen.
De onderzoeksgroep van professor Carsten Soennichsen bij JGU gebruikt al jaren gouden nanodeeltjes als sensoren om kleine hoeveelheden eiwitten in microscopisch kleine stroomcellen te detecteren. Gouden nanodeeltjes fungeren als kleine antennes voor licht: ze absorberen en verstrooien het sterk en zien er kleurrijk uit. Ze reageren op veranderingen in hun omgeving door van kleur te veranderen. Het team van Soennichsen heeft dit concept benut voor geïmplanteerde medische detectie.
Om te voorkomen dat de kleine deeltjes zich verspreiden of worden afgebroken door immuuncellen, worden ze ingebed in een poreuze hydrogel met een weefselachtige consistentie. Eenmaal onder de huid geïmplanteerd, groeien kleine bloedvaten en cellen in de poriën. De sensor is in het weefsel geïntegreerd en wordt niet als vreemd lichaam afgewezen. “Onze sensor is als een onzichtbare tatoeage, niet veel groter dan een cent en dunner dan een millimeter”, zegt professor Carsten Soennichsen, hoofd van de Nanobiotechnology Group bij JGU. Omdat de gouden nanodeeltjes reflecteren in de infrarode golflengte, zijn ze niet zichtbaar voor het oog. Een speciaal soort meetapparaat kan hun kleur echter op niet-invasieve wijze via de huid detecteren.
In hun studie gepubliceerd in Nano Lettersimplanteerden de JGU-onderzoekers hun gouden nanodeeltjes sensoren onder de huid van haarloze ratten. Kleurveranderingen in deze sensoren werden gevolgd na toediening van verschillende doses van een antibioticum. De medicijnmoleculen werden via de bloedbaan naar de sensor getransporteerd. Door zich te binden aan specifieke receptoren op het oppervlak van de gouden nanodeeltjes, veroorzaken ze een kleurverandering die afhankelijk is van de geneesmiddelconcentratie. Dankzij de kleurstabiele gouden nanodeeltjes en de weefselintegrerende hydrogel bleek de sensor mechanisch en optisch stabiel te blijven gedurende enkele maanden.
“We zijn gewend dat gekleurde objecten na verloop van tijd bleken. Gouden nanodeeltjes bleken echter niet, maar behouden hun kleur permanent. Omdat ze gemakkelijk kunnen worden gecoat met verschillende receptoren, zijn ze een ideaal platform voor implanteerbare sensoren”, legt Dr. Katharina uit. Kaefer, eerste auteur van de studie.
Het nieuwe concept is generaliseerbaar en heeft het potentieel om de levensduur van implanteerbare sensoren te verlengen. In de toekomst kunnen implanteerbare sensoren op basis van gouden nanodeeltjes worden gebruikt om gelijktijdig concentraties van biomarkers of medicijnen in het lichaam te observeren. Dergelijke sensoren kunnen worden toegepast bij de ontwikkeling van geneesmiddelen, medisch onderzoek of gepersonaliseerde geneeskunde, zoals het beheer van chronische ziekten.
Soennichsen kwam op het idee om gouden nanodeeltjes te gebruiken als geïmplanteerde sensoren in 2004, toen hij zijn onderzoek in de biofysische chemie begon als junior professor in Mainz. Het project werd echter pas 10 jaar later gerealiseerd in samenwerking met Dr. Thies Schroeder en Dr. Katharina Kaefer, beide wetenschappers van JGU. Schroeder had ervaring in biologisch onderzoek en proefdierkunde en had al een aantal jaren onderzoekswerk in de VS voltooid
Kaefer was op zoek naar een spannend onderwerp voor haar doctoraat en was vooral geïnteresseerd in het complexe en interdisciplinaire karakter van het project. De eerste resultaten leidden tot een stipendium dat aan Kaefer werd toegekend door het Max Planck Graduate Center (MPGC) en financiële steun van Stiftung Rheinland-Pfalz für Innovation. “Zo’n project vereist veel mensen met verschillende wetenschappelijke achtergronden. Stap voor stap hebben we steeds meer mensen van ons idee kunnen overtuigen”, aldus Soennichsen. Uiteindelijk was het interdisciplinair teamwerk dat resulteerde in de succesvolle ontwikkeling van de eerste functionele geïmplanteerde sensor met gouden nanodeeltjes.
Katharina Kaefer et al, implanteerbare sensoren op basis van gouden nanodeeltjes voor continue langetermijnconcentratiebewaking in het lichaam, Nano Letters (2021). DOI: 10.1021 / acs.nanolett.1c00887
Nano Letters
Geleverd door Universitaet Mainz