Krediet: DGIST (Daegu Gyeongbuk Instituut voor Wetenschap en Technologie)
Daegu Gyeongbuk Institute of Science & Technology (DGIST, president Yang Kook) Professor Hongsoo Choi’s team van de afdeling Robotica en Mechatronica Engineering werkte samen met het team van professor Sung-Won Kim in Seoul St. Mary’s Hospital, Katholieke Universiteit van Korea, en professor Bradley J Nelson’s team bij ETH Zürich om een technologie te ontwikkelen die meer dan 100 microrobots per minuut produceert die in het lichaam kunnen worden gedesintegreerd.
Microrobots die gericht zijn op minimaal invasieve gerichte precisietherapie kunnen op verschillende manieren worden vervaardigd. Onder hen is ultrafijne 3D-printtechnologie, de zogenaamde twee-foton-polymerisatiemethode, een methode die polymerisatie veroorzaakt door twee lasers in synthetische hars te kruisen, het meest gebruikt. Deze technologie kan een structuur produceren met precisie op nanometerniveau. Een nadeel is echter dat het produceren van één microrobot tijdrovend is omdat voxels, de pixels die door 3D-printen worden gerealiseerd, achtereenvolgens moeten worden uitgehard. Bovendien kunnen de magnetische nanodeeltjes in de robot het lichtpad blokkeren tijdens het polymerisatieproces met twee fotonen. Dit procesresultaat is mogelijk niet uniform bij gebruik van magnetische nanodeeltjes met een hoge concentratie.
Om de beperkingen van de bestaande productiemethode voor microrobots te overwinnen, ontwikkelde het onderzoeksteam van DGIST Professor Hongsoo Choi een methode om microrobots te creëren met een hoge snelheid van 100 per minuut door een mengsel van magnetische nanodeeltjes en gelatinemethacrylaat te laten stromen, dat biologisch afbreekbaar is en kan worden genezen door licht, in de microfluïdische chip. Dit is meer dan 10.000 keer sneller dan het gebruik van de bestaande twee-foton-polymerisatiemethode om microrobots te maken.
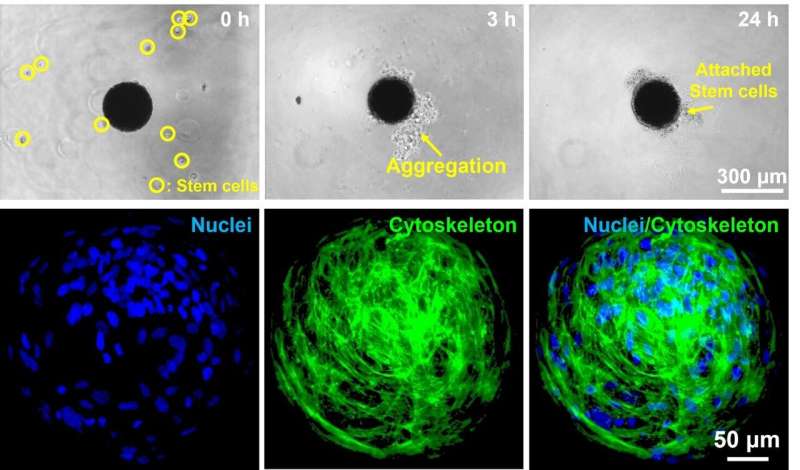
Vervolgens werd de microrobot die met deze technologie werd geproduceerd, gekweekt met menselijke nasale turbinated stamcellen verzameld uit de menselijke neus om stamceladhesie aan het oppervlak van de microrobot te induceren. Door dit proces werd een stamcel gefabriceerd die een microrobot droeg, inclusief magnetische nanodeeltjes aan de binnenkant en stamcellen die aan het buitenoppervlak waren bevestigd. De robot beweegt terwijl de magnetische nanodeeltjes in de robot reageren op een extern magnetisch veld en kan naar een gewenste positie worden verplaatst.
Selectieve celafgifte was moeilijk in het geval van de bestaande stamceltherapie. De stamceldragende microrobot kan echter naar een gewenste locatie gaan door het magnetische veld dat wordt gegenereerd door het elektromagnetische veldbesturingssysteem in realtime te regelen. Het onderzoeksteam voerde een experiment uit om te onderzoeken of de stamceldragende microrobot het doelwit kon bereiken door door een doolhofvormig microkanaal te gaan, en bevestigde bijgevolg dat de robot naar de gewenste locatie kon bewegen.
Bovendien werd de afbreekbaarheid van de microrobot geëvalueerd door de stamceldragende microrobot te incuberen met afbrekend enzym. Na 6 uur incubatie was de microrobot volledig uiteengevallen en werden de magnetische nanodeeltjes in de robot verzameld door het magnetische veld dat werd gegenereerd door het magnetische veldbesturingssysteem. Stamcellen werden vermeerderd op de plaats waar de microrobot was gedesintegreerd. Vervolgens werden de stamcellen geïnduceerd om te differentiëren tot zenuwcellen om normale differentiatie te bevestigen; de stamcellen werden na ongeveer 21 dagen gedifferentieerd tot zenuwcellen. Dit experiment bevestigde dat het afleveren van stamcellen op een gewenste locatie met behulp van een microrobot mogelijk was en dat de afgeleverde stamcellen konden dienen als een gericht precisietherapeutisch middel door proliferatie en differentiatie te vertonen.
Verder bevestigde het onderzoeksteam of de door de microrobot geleverde stamcellen normale elektrische en fysiologische kenmerken vertoonden. Het uiteindelijke doel van dit onderzoek is ervoor te zorgen dat de stamcellen die door de robot worden aangeleverd, normaal gesproken hun brugfunctie vervullen in een toestand waarin de verbinding tussen de bestaande zenuwcellen wordt verbroken. Om dit te bevestigen, werden hippocampale neuronen gebruikt die werden geëxtraheerd uit rattenembryo’s die stabiel elektrische signalen uitzenden. De overeenkomstige cel werd bevestigd aan het oppervlak van de microrobot, gekweekt op een micro-elektrodechip en na 28 dagen werden elektrische signalen waargenomen van de hippocampale neuronen. Hierdoor werd geverifieerd dat de microrobot zijn rol als celafleveringsplatform goed vervult.
DGIST-professor Hongsoo Choi zei: “We verwachten dat de technologieën die tijdens deze studie zijn ontwikkeld, zoals massaproductie van microrobots, nauwkeurige werking door elektromagnetische velden en stamcelafgifte en -differentiatie, de efficiëntie van gerichte precisietherapie in de toekomst drastisch zullen verhogen. “
Inmiddels zijn de resultaten van deze studie op 23 juni gepubliceerd in het wetenschappelijke tijdschrift Klein .
Seungmin Noh et al, een biologisch afbreekbare magnetische microrobot op basis van gelatinemethacrylaat voor nauwkeurige levering van stamcellen met massaproductievermogen, Klein (2022). DOI: 10.1002/smll.202107888
Klein
Geleverd door DGIST (Daegu Gyeongbuk Instituut voor Wetenschap en Technologie)