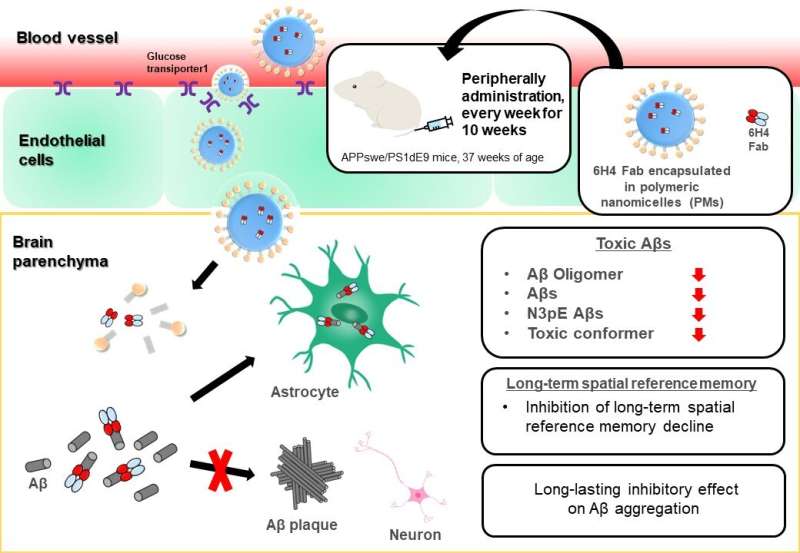
De nieuw ontwikkelde antilichaam-6H4-fragmenten (Fabs) die specifiek zijn voor Aβ-oligomeren, ingekapseld in de polymere nanomicellen (PM’s), werden gedurende 10 weken perifeer toegediend aan AD-modelmuizen. Bij muizen die anti-AβO 6H4 Fabs in de PM’s kregen toegediend, waren verschillende toxische Aβ-soorten (Aβ-oligomeren, Aβ42s, N3pE Aβs, Aβs met toxische conformer) en de aanwezigheid van Aβ-plaques met dichte kernen in de hersenen significant verminderd. Bovendien werd de onderdrukking van de progressie van pathologische processen van AD ondersteund door de preventie van cognitief-gedragsmatige achteruitgang in de ruimtelijke geheugentests. Krediet: Afdeling Neurologie en Neurologische Wetenschappen, TMDU
Soms komen de beste dingen in het leven bij toeval, als we op het juiste moment op de juiste plaats zijn. Nu hebben onderzoekers uit Japan een manier gevonden om ervoor te zorgen dat nieuwe medicijnen op de juiste plaats in het lichaam en op het juiste tijdstip in ziekteprogressie worden afgeleverd, zodat ze het beste effect hebben.
In een studie die onlangs is gepubliceerd in de Journal of Nanobiotechnologiehebben onderzoekers onder leiding van de Tokyo Medical and Dental University (TMDU) onthuld dat een nieuw toedieningssysteem de behandeling levert daar waar deze het meest nodig is in een muismodel van de ziekte van Alzheimer (AD).
AD is een veel voorkomende neurodegeneratieve ziekte die dementie veroorzaakt. Het wordt gekenmerkt door de ophoping van een eiwit genaamd amyloïde β (Aβ) in de hersenen, en er zijn een aantal verschillende toxische vormen van Aβ geïdentificeerd die de hersenfunctie aantasten, met name Aβ-oligomeren (AβO’s).
“Meerdere klinische onderzoeken hebben geprobeerd een anti-Aβ-antilichaam te gebruiken om AD te behandelen, maar de resultaten waren onbevredigend”, zegt hoofdauteur van de studie Akiko Amano. “Een mogelijke verklaring hiervoor is dat de bloed-hersenbarrière (BBB) verhindert dat de meeste antilichamen van volledige lengte de hersenen binnendringen.”
Om deze uitdaging aan te gaan, ontwikkelden de onderzoekers eerder geglucosyleerde (suikergekoppelde) polymere nanomicellen (PM’s), kleine, holle balletjes die met succes de BBB kunnen passeren via transcytose in capillaire endotheelcellen van muizenhersenen; dit proces werd gemedieerd door glucose-transporter-1 en geïnduceerd door een verhoging van de bloedglucosespiegels nadat de muizen nuchtere omstandigheden hadden ervaren.
In deze studie vulden Takanori Yokota en collega’s PM’s met fragmenten van een anti-AβO-antilichaam, injecteerden ze in een muismodel van AD en beoordeelden de effecten op de hersenen en op gedrag.
“De resultaten waren heel duidelijk”, legt senior auteur Nobuo Sanjo uit. “Toediening van anti-AβO-antilichaamfragmenten via PM’s verminderde de hoeveelheden van verschillende toxische Aβ-soorten aanzienlijk. Bovendien waren de Aβ-plaques die zich vormden kleiner en minder dicht dan die bij onbehandelde muizen.”
Vervolgens analyseerden de onderzoekers het gedrag van de muizen en ontdekten dat de muizen die werden behandeld met de met antilichaamfragmenten gevulde PM’s een beter leer- en ruimtelijk geheugen hadden dan onbehandelde muizen. “Onze bevindingen suggereren dat het afleveren van voldoende niveaus van antilichamen aan de hersenen met behulp van PM’s toxische Aβ-soorten kan verminderen en de progressie van AD bij muizen kan vertragen”, zegt Amano.
Aangezien het falen van anti-Aβ-antilichamen om de cognitieve functie in klinische onderzoeken bij mensen te verbeteren waarschijnlijk was vanwege een onvoldoende toevoer van de antilichamen in de hersenen, zouden PM-ingekapselde antilichaamfragmenten een effectieve manier kunnen zijn om AD-progressie te voorkomen. Bovendien zouden nieuwe kandidaten voor de behandeling van AD die toxische Aβ’s afbreken en hun toxische effecten verminderen, ook aan de hersenen kunnen worden toegediend met hetzelfde op PM gebaseerde systeem.
Meer informatie:
Akiko Amano et al. Perifere toediening van in nanomicelle ingekapseld anti-Aβ-oligomeerfragment-antilichaam vermindert verschillende toxische Aβ-soorten in de hersenen, Journal of Nanobiotechnologie (2023). DOI: 10.1186/s12951-023-01772-y
Aangeboden door Tokyo Medical and Dental University