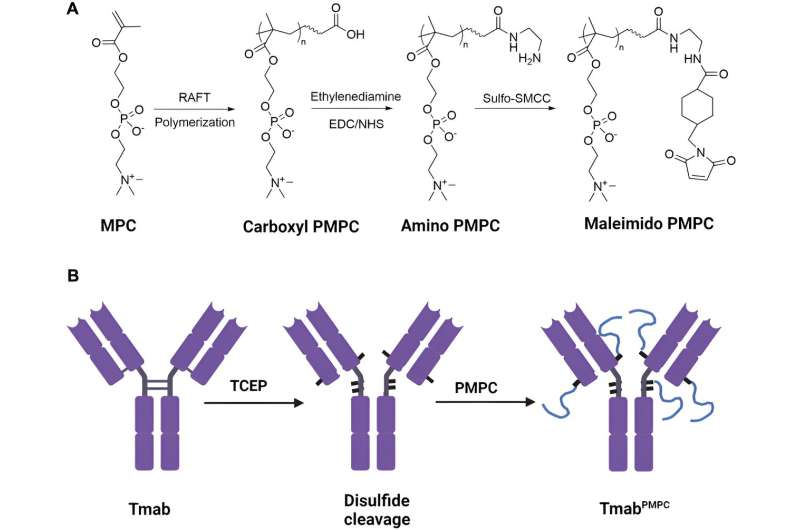
Synthetisch proces van PMPC-polymeren en TmabPMPCS. (A) Synthetisch proces van met thiol reactief maleïmide-gemodificeerd PMPC. MPC werd eerst gepolymeriseerd na een RAFT-polymerisatie om PMPC met carboxylgroepen te verkrijgen. Vervolgens werd de eindgroep omgezet in een aminogroep met ethyleendiamine-modificatie, gevolgd door het omzetten van de aminogroep in de maleïmidegroep door Sulfo-SMCC om maleïmide-gemodificeerd PMPC te verkrijgen. (B) Synthetisch proces van TmabPMPC productie. De disulfidebindingen tussen de ketens van Tmab werden eerst door TCEP gekliefd om thiolgroepen te creëren, gevolgd door reactie met maleïmide-gemodificeerd PMPC om Tmab te verkrijgenPMPC. Credit: Grenzen in cel- en ontwikkelingsbiologie (2023). DOI: 10.3389/fcell.2023.1214118
De bloed-hersenbarrière blokkeert de toegang van antilichamen tot de hersenen. Dit beperkt het potentiële gebruik van antilichaamtherapieën voor de behandeling van hersenziekten, zoals hersentumoren.
Elders in het lichaam worden door medische teams meer dan 100 door de Amerikaanse Food and Drug Administration goedgekeurde therapeutische antilichamen gebruikt om kanker, auto-immuunziekten, infectieziekten en stofwisselingsziekten te behandelen. Het vinden van manieren om therapeutische antilichamen door de bloed-hersenbarrière te transporteren – van de perifere bloedstroom naar het centrale zenuwstelsel – zou effectieve behandelingen kunnen opleveren die in de hersenen werken.
In een nieuwe studie gepubliceerd in het tijdschrift Grenzen in cel- en ontwikkelingsbiologieOnderzoekers van de Universiteit van Alabama in Birmingham rapporteren dat de plaatsgerichte toevoeging van een door de FDA goedgekeurd, biologisch afbreekbaar polymeer aan de scharnier- en nabije scharniergebieden van het therapeutische antilichaam trastuzumab de afgifte aan de hersenen van dit menselijke monoklonale IgG1-antilichaam effectief vergemakkelijkte. Trastuzumab wordt gebruikt voor de behandeling van borstkanker en verschillende andere vormen van kanker.
Het voorbereidende werk aan dit nieuwe platform omvatte in vitro- en muismodelexperimenten. Onderzoekers zeggen dat het toedieningssysteem nog verder moet worden geoptimaliseerd en getest, maar merken op dat hun eenvoudige methodologie antilichaamtherapieën omzet in een door de hersenen afleverbare vorm die de medische functionaliteit van het antilichaam behoudt.
“De zorgen over het binnendringen van de hersenen achtervolgen de ontwikkeling van op hersenziekten gerichte antilichaamtherapieën, waardoor de medische vertalingen van in het laboratorium gegenereerde antilichamen naar klinische praktijken worden belemmerd”, zegt Masakazu Kamata, Ph.D., leider van de studie en universitair hoofddocent. bij de afdeling Microbiologie van de UAB. “In deze context heeft deze eenvoudige methodologie een groot potentieel om als platform te dienen om niet alleen de huidige antilichaamtherapieën opnieuw te gebruiken, maar ook om het ontwerp van nieuwe antilichamen aan te moedigen voor de behandeling van hersenziekten.”
Het gebruikte biocompatibele polymeer was poly-2-methacryloyloxyethylfosforylcholine, of PMPC, met ketenlengten van 50, 100 of 200 monomeren. De onderzoekers hadden al ontdekt dat dit niet-immunogene polymeer, dat door de FDA is goedgekeurd als coatingmateriaal voor transplanteerbare apparaten, zich zou kunnen binden aan twee receptoren op microvasculaire endotheelcellen in de hersenen die de bloed-hersenbarrière vormen, en die cellen zouden vervolgens het polymeer kunnen verplaatsen door de bloed-hersenbarrière door transcytose. Transcytose is een gespecialiseerd transport waarbij extracellulaire lading de cel binnen wordt gebracht, door het cytoplasma naar de andere kant van de cel wordt vervoerd en vervolgens wordt vrijgegeven.
De UAB-onderzoekers waren in staat om vier disulfidebindingen tussen de ketens in de trastuzumab IgG1-scharnier- en nabij-scharniergebieden te splitsen, waardoor thiolgroepen ontstonden. Elke thiolgroep werd vervolgens geconjugeerd aan een keten van de PMPC om trastuzumab-moleculen te creëren met een van de drie ketenlengtes, die ze aanduiden als Tmab-PMPC50, Tmab-PMPC100 en Tmab-PMPC200.
Elk van deze gemodificeerde antilichamen handhaafde nog steeds de trastuzumab-specifieke binding aan cellen die het HER2-antigeen, het doelwit van trastuzumab, tot expressie brengen. Zowel de Tmab-PMPC50 als de Tmab-PMPC100 werden geïnternaliseerd in HER2-positieve cellen en bevorderden antilichaamafhankelijke celdood, wat de medische functionaliteit is waarmee trastuzumab HER2+-borstkankercellen doodt.
De onderzoekers toonden vervolgens aan dat PMPC-conjugatie van trastuzumab de penetratie van de bloed-hersenbarrière door de epitheelcellen op de bloed-hersenbarrière verbeterde via de transcytoseroute. Het transloceerbare Tmab-PMPC100 was de beste wat betreft efficiënte penetratie van de bloed-hersenbarrière, terwijl de epitoopherkenning van trastuzumab, het vermogen van het antilichaam om zich aan zijn antigeendoelwit te binden, behouden bleef.
In een muismodel waren zowel Tmab-PMPC100 als Tmab-PMPC200 ongeveer vijf keer beter in hersenpenetratie dan natief trastuzumab. In voorlopige in vitro- en muismodelexperimenten induceerde het polymeer-gemodificeerde trastuzumab geen neurotoxiciteit, vertoonde het geen nadelige effecten in de lever en verstoorde het de integriteit van de bloed-hersenbarrière niet.
“Deze bevindingen geven gezamenlijk aan dat PMPC-conjugatie een effectieve hersenafgifte van therapeutische antilichamen, zoals trastuzumab, bereikt zonder nadelige effecten te veroorzaken, tenminste in de lever, de bloed-hersenbarrière of de hersenen,” zei Kamata.
Anderen hebben ook manieren onderzocht om ladingachtige antilichamen door de bloed-hersenbarrière te krijgen, merkten de onderzoekers op.
In werk dat tot de huidige studie heeft geleid, hadden de UAB-onderzoekers voor de huidige studie aangetoond dat ze verschillende macromoleculaire ladingen in PMPC-omhulsels konden wikkelen, en deze nanocapsules vertoonden een verlengde bloedcirculatie, verminderde immunogeniciteit en verbeterde hersenafgifte bij muizen en niet-menselijke primaten.
Toch had dit systeem nadelen. De nanocapsules vereisten de toevoeging van doelgerichte liganden om ze naar hun ziektedoel te brengen en afbreekbare crosslinkers die het vrijkomen van de lading op die plek mogelijk zouden maken. Helaas ontberen ziekte-geassocieerde micro-omgevingen vaak omstandigheden die degradatie van de crosslinkers kunnen veroorzaken.
Andere onderzoekers die de bloed-hersenbarrière proberen te doorbreken, hebben verschillende andere liganden dan PMPC onderzocht om het transport te stimuleren, zoals liganden afgeleid van microben en toxines, of endogene eiwitten zoals lipoproteïnen. Deze hebben over het algemeen ongewenste oppervlakte-eigenschappen gehad, zoals zeer immunogeen, zeer hydrofoob of geladen. PMPC vertoont deze ongewenste eigenschappen niet.
Co-auteurs met Kamata in de studie, “Site-georiënteerde conjugatie van poly (2-methacryloyloxyethylfosforylcholine) voor verbeterde hersenafgifte van antilichaam”, zijn Jie Ren, Chloe E. Jepson, Charles J. Kuhlmann, Stella Uloma Azolibe en Madison T. Blucas, afdeling Microbiologie van de UAB; Sarah L. Nealy en Eugenia Kharlampieva, UAB Afdeling Scheikunde; Satoru Osuka, UAB Afdeling Neurochirurgie; en Yoshiko Nagaoka-Kamata, UAB Afdeling Pathologie.
Meer informatie:
Jie Ren et al., Plaatsgerichte conjugatie van poly(2-methacryloyloxyethylfosforylcholine) voor verbeterde afgifte van antilichaam aan de hersenen, Grenzen in cel- en ontwikkelingsbiologie (2023). DOI: 10.3389/fcell.2023.1214118
Geleverd door de Universiteit van Alabama in Birmingham