Credit: ACS Nano (2023). DOI: 10.1021/acsnano.3c04333
Wetenschappers van Northwestern Medicine hebben volgens een nieuwe studie een effectievere manier ontwikkeld om nanotherapeutische vaccins en medicijnen te maken gepubliceerd in ACS Nano.
“De afgelopen tien jaar is de technologie van sferisch nucleïnezuur, of SNA, naar voren gekomen als een breed therapeutisch platform voor een breed scala aan ziekten, waaronder kanker en andere ziekten”, zegt Chad Mirkin, Ph.D., hoogleraar geneeskunde aan de afdeling. van Hematologie en Oncologie, de George B. Rathmann hoogleraar scheikunde aan het Weinberg College of Arts and Sciences in Northwestern, en directeur van het International Institute for Nanotechnology, die de hoofdauteur van het onderzoek was.
In het Mirkin-laboratorium hebben onderzoekers deze SNA-technologie benut in hun werk om precisie-nanomedicijnen te ontwerpen voor gebruik bij genregulatie en bij kankerimmunotherapie met beperkte ongewenste bijwerkingen via een systematisch ontwikkelingsproces dat bekend staat als rationele vaccinologie.
“Bij de ontwikkeling van vaccins is historisch gezien zeer weinig aandacht besteed aan de vaccinstructuur”, zegt Mirkin, die ook lid is van het Robert H. Lurie Comprehensive Cancer Center van de Northwestern University. “Alle nadruk lag op de componenten. Het uitgangspunt van de rationele vaccinologie is dat, hoewel componenten van cruciaal belang zijn, structuur even belangrijk is. Hoe je vaccincomponenten presenteert binnen een modulaire architectuur op nanoschaal kan een dramatische impact hebben op de werkzaamheid van vaccins, of het nu gaat om behandeling van infectieziekten of kanker.”
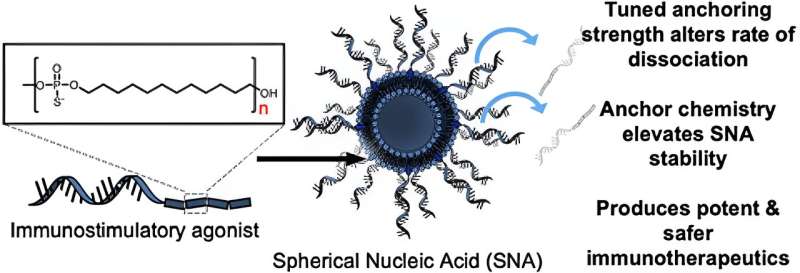
In het onderzoek testten onderzoekers eerst de effecten van het gebruik van verschillende chemische verankeringsgroepen om de oligonucleotiden (korte DNA- of RNA-strengen) aan het oppervlak van de liposomen te hechten om SNA’s te bereiden. Ze ontdekten dat wanneer steeds meer hydrofobe, op dodecaan gebaseerde ankergroepen werden gebruikt, de stabiliteit van de nanostructuur aanzienlijk werd verbeterd. Wanneer ze werden geïntroduceerd in van beenmerg afkomstige dendritische cellen van muizen, vertoonden deze stabielere SNA-constructen een verbeterde cellulaire opname vergeleken met de andere versies van SNA’s die waren bereid met behulp van andere soorten verankerende groepen, met verschillende chemie.
“We hebben een manier ontdekt om de oligonucleotiden aan het oppervlak van het deeltje te verankeren, waardoor de algehele stabiliteit van het SNA-construct verandert, wat van cruciaal belang is”, zegt Jasper Dittmar, een Ph.D. student in het Mirkin-laboratorium en co-auteur van het onderzoek. “Het mooie van de SNA-architectuur is dat deze door bijna alle celtypen wordt herkend, inclusief immuuncellen, en snel wordt geïnternaliseerd. Je zorgt ervoor dat het vaccin de cellen binnendringt die er toe doen met de stoichiometrie die je wilt, met het gewenste aantal antigenen en hulpmoleculen.”
Wetenschappers in het Mirkin-laboratorium laadden vervolgens het SNA-vaccin met OVA1 (een modelpeptide afgeleid van ei-eiwit dat vaak wordt gebruikt bij de ontwikkeling van vaccins) en dienden dat toe aan muizen met lymfoom. De met OVA1 SNA behandelde muizen hadden niet alleen een groter aantal polyfunctionele T-cellen (die als krachtig worden beschouwd tegen chronische infecties en tumoren), ze vertoonden ook een 21-voudige vermindering van het tumorvolume vergeleken met met zoutoplossing behandelde muizen, aldus de studie. studie.
Om de ontstekingsbijwerkingen van het vaccin te beoordelen, bestudeerden onderzoekers vervolgens de SNA om te zien of deze overmatige immuunreacties bij muizen activeerde. Muizen die de behandeling kregen, produceerden geen cytokinestorm, een soms fatale bijwerking van immuuntherapieën.
Omdat cytokinestormen in verband worden gebracht met ernstige gevallen van COVID-19, hebben Mirkin en zijn onderzoeksteam ook een SNA-vaccin ontwikkeld waarbij het OVA1-peptide werd vervangen door een peptide van het virus dat COVID-19 veroorzaakt (CoV-peptide) en dit aan mensen toegediend. cellen en uiteindelijk muizen. De onderzoekers ontdekten dat het vaccin de antigeenspecifieke anti-COVID-immuunreacties versterkte met minimale nadelige bijwerkingen.
“Alles bij elkaar leggen de resultaten van deze studie een basis voor een nieuwe manier om vaccins en andere precisiebehandelingen te ontwikkelen en af te leveren, ongeacht de doelziekte”, zegt Michael Evangelopoulos, een Ph.D. student in het Mirkin-lab en co-auteur van het onderzoek.
De bevindingen benadrukken ook het belang van de vaccinconstructie, zei Mirkin.
“Structuur is belangrijk”, zei Mirkin. “Op een gebied waar we heel weinig tijd hebben besteed aan de structuur van vaccins, hebben we misschien door de bomen het bos gemist. Het is een gecombineerd begrip van de componenten en de structurele presentatie die leidt tot een effectief medicijn of niet. .”
In de toekomst zal de Mirkin-groep doorgaan met het bedenken van verschillende configuraties van SNA-vaccins om te beoordelen welke het meest effectief zijn, zei hij.
“We besteden veel tijd aan het gebruik van het SNA-platform om erachter te komen welke structuren het meest effectief zijn, en proberen vervolgens uit te vinden waarom dat zo is, wat werkt en ook waarom het werkt,” zei Mirkin. “Wij denken dat we door dat te doen een hele nieuwe generatie medicijnen kunnen creëren, gebaseerd op dit concept van rationele vaccinologie.”
Meer informatie:
Jasper W. Dittmar et al., DNA-dissociatie afstemmen op sferische nucleïnezuren voor verbeterde immunostimulatie, ACS Nano (2023). DOI: 10.1021/acsnano.3c04333
Tijdschriftinformatie:
ACS Nano
Geleverd door Northwestern University