Credit: Opto-elektronische vooruitgang (2024). DOI: 10.29026/oea.2024.240013
Fototherapie is een veilige en effectieve methode voor de behandeling van tumoren, waaronder fotothermische therapie (PTT) en fotodynamische therapie (PDT). PTT verwijst naar het gebruik van laser om fotothermische conversiemiddelen te activeren en hoge temperaturen te gebruiken om tumorcellen te doden, terwijl PDT fotosensitizers stimuleert om reactieve zuurstofsoorten (ROS) te produceren om tumorcellen te doden.
Studies hebben het gecombineerde therapeutische potentieel van PTT/PDT aangetoond, maar door het lage zuurstofgehalte in tumoren is monotherapie vaak onvoldoende om efficiënte en langdurige therapeutische effecten op tumoren te bewerkstelligen.
Tegelijkertijd is het vermogen van fototherapie om de immuunrespons tegen kanker op te wekken beperkt, en is het moeilijk om door lokale immuunstimulatie de systemische antitumorale immuunrespons te activeren. Om het vermogen van fototherapie om de systemische immuunrespons te stimuleren te verbeteren, is verder onderzoek nodig.
Stikstofmonoxide (NO) heeft meerdere functies in de fysiologische en pathologische processen van het menselijk lichaam, en er vindt een kritische interactie plaats tussen stikstofoxide en reactieve zuurstofsoorten (ROS) geproduceerd door PDT om reactieve stikstofsoorten (RNS) te vormen.
Deze RNS zouden de werkzaamheid van PDT onder hypoxische omstandigheden kunnen verbeteren door tumorcellen te doden, terwijl ze ook de immuunrespons aanzienlijk beïnvloeden.
De huidige studie toont aan dat RNS immunosuppressieve cellen kan onderdrukken en tumor-geassocieerde macrofagen kan polariseren tot M1-achtige fenotypes. De strategie van het genereren van NO/ROS/RNS-cascades heeft dus een groot potentieel bij het activeren van systemische, langdurige antitumorimmuunreacties.
Het genereren van RNS wordt echter belemmerd door de moeilijkheid om de locatie en timing van NO-afgifte nauwkeurig te controleren, evenals door de korte levensduur (meestal 3-6 ms) en het beperkte diffusiebereik (~ 20 nm) van singletzuurstof.
Door gebruik te maken van nanodeeltjes om tegelijkertijd NO-donor en fotosensitizer af te geven, en door laserbestraling op de tumorplaats toe te passen om tegelijkertijd PTT/PDT te initiëren, kan ter plaatse een cascade van NO/ROS/RNS-afgifte worden bereikt, wat aanzienlijk de productie van RNS en de antitumorale werkzaamheid verbeteren.
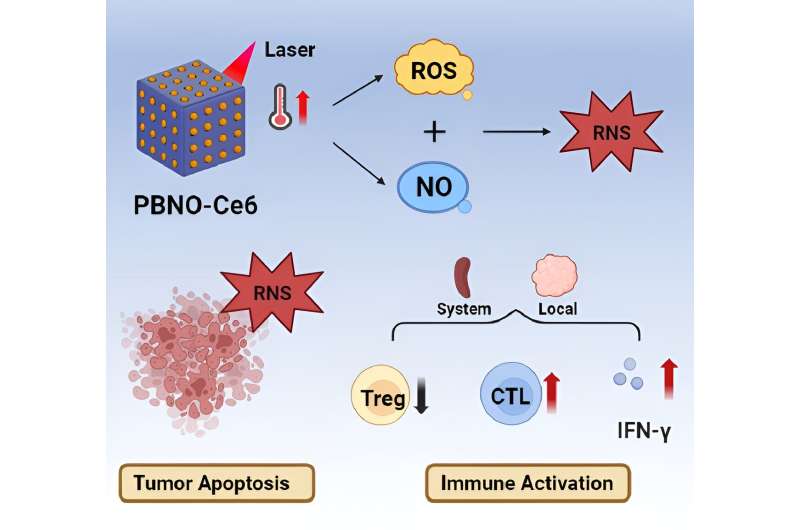
De auteurs van een nieuwe studie stellen een NIR-trigger-geactiveerde reactieve stikstof-nanoreactor (PBNO-Ce6) voor, die tegelijkertijd ter plekke stikstofmonoxide (NO), reactieve zuurstofsoorten (ROS) en reactieve stikstofsoorten (RNS) kan produceren om de tumor te doden. cellen in vivo, versterken de lokale en systemische anti-tumor immuunrespons op lange termijn en beschermen het weefsel tegen de heraanval van tumoren. Het papier is gepubliceerd in het journaal Opto-elektronische vooruitgang.
Deze nanoreactor is gebaseerd op Pruisisch blauwe nanodeeltjes (PB). PBNO-nanodeeltjes, die NO kunnen afgeven na laserstimulatie, werden eerst gesynthetiseerd door natriumnitroprusside (SNP) in de kristalstructuur van PB als NO-donor te doteren, en vervolgens werd de fotosensitizer Ce6 op de mesoporie van het oppervlak van de nanodeeltjes geladen om PTT / PDT te bereiken combinatietherapie.
Het vrijgekomen NO combineert met ROS geproduceerd door fotosensitizers voor RNS, wat het fotodynamische/fotothermische therapeutische effect op tumoren aanzienlijk verbetert en de antitumorimmuunrespons activeert.
Er werd bevestigd dat PBNO-Ce6 werd opgewarmd door laserbestraling en dat het tumordodende vermogen van NO gecombineerd met ROS in vitro en in vivo significant was toegenomen in vergelijking met monotherapie. Zoals blijkt uit de resultaten van kleuring van levende dode cellen en flowcytometrie, induceerde PBNO-Ce6 meer apoptose in tumorcellen.
Van groter belang was het vermogen ervan om de activering van de immuunrespons te moduleren, waarbij behandeling met PBNO-Ce6 leidde tot een significante 2,7-voudige toename van cytotoxische T-lymfocyten en een vermindering van 62% in regulerende T-cellen vergeleken met controle-PB-Ce6 (Pruisisch blauw). nanodeeltjes geladen met Ce6), wat een significante verbetering aangeeft ten opzichte van conventionele PTT/PDT.
PBNO-Ce6 fungeert als een ongekende NIR-getriggerde RNS-nanoreactor met synergetische fotodynamische/fotothermische effecten en krachtige immuunstimulerende activiteit. Deze ontwerpstrategie kan worden gebruikt als een veelzijdig platform in combinatie met immuuncheckpointremmers of chemotherapie om de prognose van maligniteiten verder te verbeteren.
Meer informatie:
Ziqing Xu et al, NIR-getriggerde NO/ROS/RNS-nanoreactor ter plaatse: cascade-versterkte fotodynamische/fotothermische therapie met activering van lokale en systemische immuunresponsen, Opto-elektronische vooruitgang (2024). DOI: 10.29026/oea.2024.240013
Geleverd door Compuscript Ltd