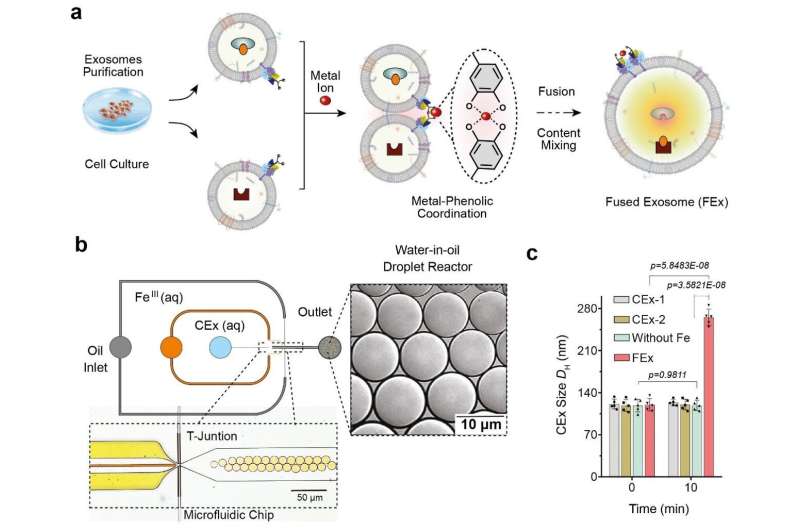
(a) Fe3+-ion triggert membraanfusie in exosomen die zijn aangepast met catechol (CEx). De vorming van een metaal-catecholcomplex brengt de exosomen dicht bij elkaar en maakt fusie mogelijk. Verschillende reactanten in elk exosoom worden vervolgens samen ingekapseld, wat het mengen en activeren van reacties in de gefuseerde exosomen (FEx) bevordert. (b) Het microfluïdische apparaat dat is ontworpen voor het genereren van water-in-olie druppelreactoren op de stroom-focusserende kruising. De twee waterige fasen (CEx en metaalzout) ontmoeten elkaar en worden aan de oliestroom (1% oppervlakteactieve stof PFPE-PEG in FC-40) geleverd om de vloeistof in druppeltjes te breken. (c) gemiddelde grootte van niet-gefuseerde exosomen (CEx-1: 121 ± 8 nm, CEx-2: 123 ± 5 nm) en gefuseerde exosomen (FEx: 265 ± 14 nm). Krediet: Instituut voor Basiswetenschappen
Cellen hebben kleine compartimenten die bekend staan als organellen die complexe biochemische reacties uitvoeren. Deze compartimenten hebben meerdere enzymen die samenwerken om belangrijke cellulaire functies uit te voeren. Onderzoekers van het Center for Soft and Living Matter binnen het Institute for Basic Science (IBS, Zuid-Korea) hebben met succes deze ruimtelijke compartimenten op nanoschaal nagebootst om ‘kunstmatige mitochondriën’ te creëren. De studie is gepubliceerd in Natuur Katalyse als omslagartikel. De onderzoekers stellen dat de technologie kan worden gebruikt om kunstmatige organellen te construeren die ATP of andere nuttige moleculen kunnen leveren aan cellen in beschadigde of zieke weefsels.
Dit werd bereikt door herprogrammering van exosomen, kleine blaasjes (diameter ~ 120 nm) die cellen gebruiken voor intercellulaire signalering. De onderzoekers voerden de experimenten uit met behulp van microfluïdische druppelreactoren, die kleine druppeltjes genereerden die even groot waren als typische cellen. (diameter ~ 10 m) De onderzoekers streefden er eerst naar om gecontroleerde fusie van deze exosomen in de druppeltjes te vergemakkelijken en ongewenste fusies te voorkomen.
Ze bereikten dit door de exosoomoppervlakken aan te passen met moleculen die catechol worden genoemd, een chelaatvormer die complexen vormt met metaalionen. Dit werd op zijn beurt gedaan door de catechol te hechten aan antilichamen die zich richten op specifieke celmarkers, zoals CD9. Door de complexvormende eigenschap van catechol kunnen ze fusies tussen exosomen aansturen wanneer ze worden gemengd met metaalionen zoals Fe3+. De membraanfusie vindt plaats wanneer de catecholen op de oppervlakken aan het ijzer binden en de blaasjes dicht bij elkaar brengen.
Onderzoekers testten eerst de effectiviteit van dit systeem door één type exosomen te laden met calceïne-Co2+ en een andere met EDTA. Wanneer de twee blaasjes samensmelten en de inhoud wordt gemengd, grijpt EDTA de Co2+ weg van calceïne, waardoor de laatste kan fluoresceren. Het team realiseerde zich dat ze succesvol waren bij de detectie van het fluorescentiesignaal, en de fusie werd verder bevestigd door de verdubbeling van de gemeten exosoomdiameter.
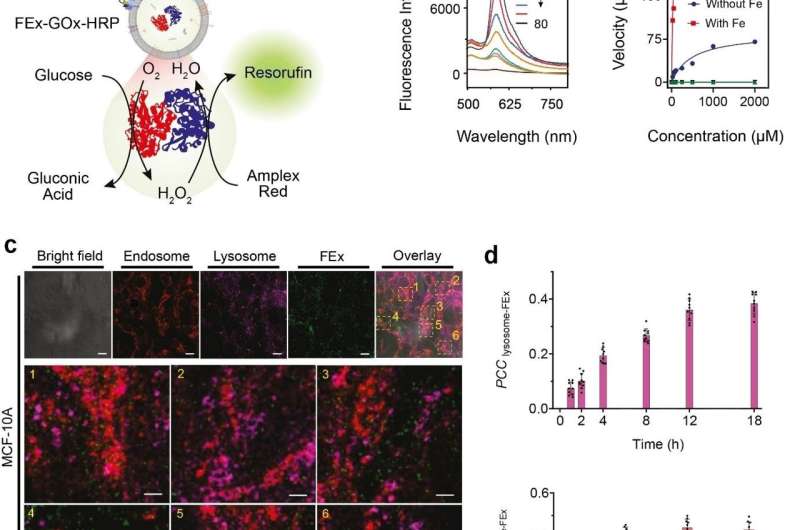
(a) Schematische weergave van een twee-enzym GOx/HRP CEx die in FEx fuseert. De katalytische reactie werd gestart door glucose toe te voegen, waarbij H2O2 werd gegenereerd door aerobe oxidatie, dat vervolgens werd gebruikt om Amplex Red te oxideren om resorufine te genereren. (b) Representatieve fluorescentiespectra van resorufine gegenereerd door biokatalyse in gefuseerde exosomen (FEx-GOx-HRP) op verschillende tijdstippen. Reactiesnelheid voor de nanoreactor versus glucoseconcentratie om kinetische constanten te berekenen door de Michaelis-Menten-vergelijking aan te passen. (c) Stabiliteit en integriteit van FEx-GOx-HRP na cellulaire integratie na 48 uur. Endosomen (EEA1, rood) lysosomen (LAMP1, magenta) en FEx (groen) worden weergegeven. ( d ) Plot van Pearson-correlatiecoëfficiënt (PCCLysosome-FEx) -waarden in de loop van de tijd voor magenta (lysosoom) en groene (FEx) fluorescentie, en voor rode (endosome) en groene (FEx) fluorescentie. Krediet: Instituut voor Basiswetenschappen
Deze aangepaste exosomen werden vervolgens voorgeladen met verschillende reactanten en enzymen, waardoor ze in biomimetische nanofabrieken veranderden. Hierdoor kunnen ze hoogwaardige biomoleculen produceren door gewenste biokatalytische transformaties op een ruimtelijk beperkte manier uit te voeren, wat niet mogelijk is met conventionele laboratoriumreageerbuizen. Het team demonstreerde deze multi-enzym biokatalytische cascadefunctie door glucose-oxidase (GOx) en mierikswortelperoxidase (HRP) in de exosomen in te kapselen. De GOx zet eerst glucose om in gluconzuur en waterstofperoxide. De HRP gebruikt op zijn beurt het waterstofperoxide dat in de eerste reactie wordt gegenereerd om Amplex Red te oxideren tot een fluorescerend product, resorufine. De onderzoekers konden zelfs nog een stap verder gaan door een derde enzym, galactosidase, dat lactose omzet in glucose, aan het mengsel toe te voegen.
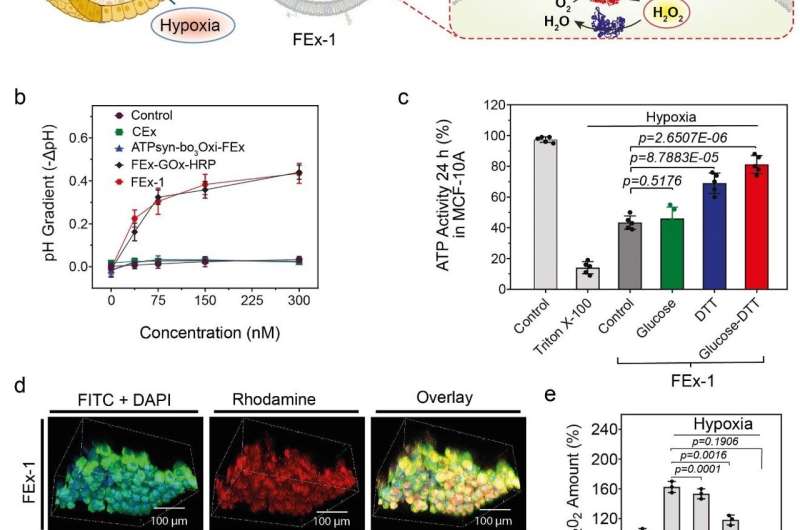
(a) Assemblage van kunstmatige organellen voor energieopwekking. ATP-synthase werd gereconstitueerd in CEx-GOx en bo3-oxidase werd gereconstitueerd in CEx-HRP. De twee CEx waren versmolten en konden diep in sferoïden doordringen. (b) Afname van de pH (-ΔpH) versus glucoseconcentraties voor verschillende exosomen. Gefuseerde exosomen vertonen een grotere mate van pH-daling. (c) Veranderingen in ATP-productie na opname van FEx-1 onder verschillende omstandigheden. (d) Kunstmatige organellen konden diep in de sferoïde doordringen. De bovenste rij toont FEx-1 (rood gemarkeerd met rhodamine B), terwijl de onderste rij gratis HRP-enzym in sferoïden toont. ( e ) Algehele ROS-niveaus namen af bij het onderwerpen van FEx-1 onder glucose en DTT. Krediet: Instituut voor Basiswetenschappen
Vervolgens wilden de onderzoekers precies weten hoe goed deze minireactoren door de cellen kunnen worden opgenomen en geïnternaliseerd. De cellen afgeleid van menselijke borstweefsels werden gevoed met gefuseerde exosome nanoreactoren en hun internalisatie gedurende de volgende 48 uur werd waargenomen met behulp van verschillende markers en een confocale laser scanning microscoop (CLSM). Het bleek dat cellen deze aangepaste exosomen voornamelijk konden opnemen via endocytose, samen met meerdere andere mechanismen. Ze testten verder het GOx-HRP twee-enzymsysteem in de cellen, en het bleek dat de gefuseerde exosomen in staat waren om met succes fluorescerende producten te produceren, zelfs terwijl ze zich in de cellen bevonden.
Gewapend met deze kennis probeerde het team functionele kunstmatige mitochondriën te creëren die in staat zijn om energie in de cellen te produceren. Om dit te bereiken, ATP-synthase en bo3 oxidase werden gereconstitueerd in de eerdere exosomen die respectievelijk GOx en HRP bevatten. Deze exosomen werden op hun beurt gefuseerd om nanoreactoren te creëren die ATP kunnen produceren met behulp van glucose en dithiothreitol (DTT). Er werd gevonden dat de gefuseerde exosomen diep in het kerndeel van een vast bolvormig weefsel konden doordringen en ATP konden produceren in zijn hypoxische omgeving. De activiteiten van deze eenvoudige organellen gingen gepaard met een duidelijke vermindering van de generatie van reactieve zuurstofspecies (ROS). Daarentegen waren vrije enzymen niet in staat om binnen deze dicht opeengepakte sferoïden van cellen te dringen.
“Al met al benadrukken onze resultaten het potentieel van deze exosomen als nanoreactoren bij het reguleren van de metabole activiteit van cellen in sferoïden en bij het verminderen van celbeschadiging als gevolg van hypoxie”, merkt CHO Yoon-Kyoung op, de corresponderende auteur van het onderzoek. Het is te hopen dat verder onderzoek naar dergelijke kunstmatige organellen een nieuw paradigma zal opleveren op verschillende gebieden, zoals diagnose en behandeling van ziekten, biotechnologie, geneeskunde en het milieu.
Geprogrammeerde exosoomfusie voor energieopwekking in levende cellen, Natuur Katalyse (2021). DOI: 10.1038/s41929-021-00669-z
Natuur Katalyse
Geleverd door Instituut voor Basiswetenschappen