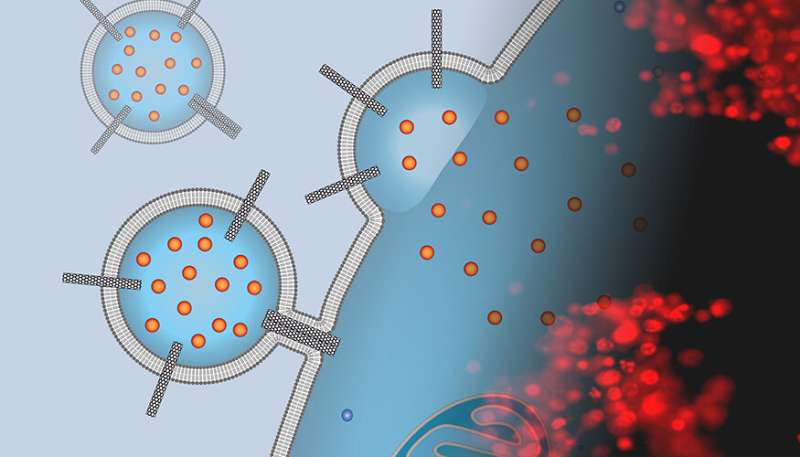
De afbeelding is een montage van de afbeelding van een kunstenaar van een liposomale geneesmiddeldrager bezaaid met koolstofnanobuisjes die aan het oppervlak van een kankercel is gekoppeld en chemotherapie-lading afgeeft met een fluorescentiemicroscopiebeeld van gekleurde cellen die aan deze dragers zijn blootgesteld. De rode vlek geeft aan dat de cellen dood zijn en dat de behandeling succesvol was. Krediet: P. Lastrico van MPI en NT Ho en A. Noy van LLNLL
De moderne geneeskunde steunt op een uitgebreid arsenaal aan medicijnen om dodelijke ziekten zoals longontsteking, tuberculose, hiv-aids en malaria te bestrijden. Chemotherapie-middelen hebben het leven van miljoenen kankerpatiënten verlengd en in sommige gevallen de ziekte genezen of in een chronische aandoening veranderd.
Maar om die medicijnen in door ziekten geteisterde cellen te krijgen, bleef een grote uitdaging voor de moderne farmacologie en geneeskunde. Om deze moeilijkheid aan te pakken, hebben Lawrence Livermore National Laboratory (LLNL) en University of California Merced-wetenschappers en medewerkers van het Max Planck Institute of Biophysics in Duitsland koolstofnanobuisjes gebruikt om directe medicijnafgifte uit liposomen via het plasmamembraan in het celinterieur mogelijk te maken. versmelting van het dragermembraan met de cel. Het onderzoek verschijnt in het Proceedings of the National Academy of Sciences.
Geneesmiddelen zijn vaak slecht oplosbaar, sterk giftig voor andere weefsels of worden snel afgebroken in de verschillende chemische omgevingen in een organisme. Ze kunnen zich ophopen in niet-doelwitweefsels, binden aan andere cellulaire componenten of kunnen niet efficiënt worden opgenomen in de doelwitcellen.
Liposomale toedieningssystemen zijn bedoeld om deze problemen te verminderen door geneesmiddelen in externe dragers in te kapselen die door de bloedbaan circuleren. Deze systemen brengen echter een afweging met zich mee tussen het verbeteren van de liposomale stabiliteit op weg naar het doelwit en het vergemakkelijken van de afgifte van nuttige lading in het cytosol van de doelcel.
De meeste huidige liposomale toedieningsstrategieën berusten op de endosomale route voor celtoegang, die inherent inefficiënt is en vaak resulteert in afbraak van het geneesmiddel. Veel gebruikte kationische lipiden, die liposomale fusie met het doelmembraan versterken en endosomale ontsnapping versterken, bleken toxisch te zijn.
“We dachten dat porines van koolstofnanobuisjes – korte stukjes koolstofnanobuisjes die in lipidemembranen worden ingebracht – de functionaliteit van virale fusiepeptiden kunnen nabootsen en kunnen helpen om de liposomale dragers te fuseren met de membranen van kankercellen,” zei wetenschapper Alex Noy, die het onderzoek leidde bij LLNL. .
In een reeks experimenten toonde het team aan dat een eenvoudig nanomateriaalplatform – een dimeer van koolstof nanobuisjes met een kleine diameter (CNTP’s) – functioneert als een krachtige promotor van membraanfusie. Bovendien, toen Noy en zijn team hun liposomen laadden met een krachtig chemotherapeutisch middel (doxorubicine), leverden deze dragers het medicijn af aan kankercellen, waarbij ze een meerderheid van hen doodden.
“Onze resultaten openen een weg voor eenvoudige en efficiënte dragers van medicijnafgifte die compatibel zijn met een breed scala aan therapieën”, zegt Nga Ho, een LLNL postdoctoraal onderzoeker en de co-eerste auteur van het artikel.
Grofkorrelige moleculaire dynamische simulaties, uitgevoerd door het team van Max Planck, onthulden een duidelijk en ongebruikelijk fusiemechanisme waarbij CNTP-dimeren de blaasjes vastbinden, de membranen naar elkaar toe trekken en vervolgens hun buitenste en binnenste bladen samensmelten.
“We waren erg blij om te zien dat membraanfusie, mogelijk gemaakt door koolstofnanobuisjes met een kleine diameter, kan leiden tot volledige menging van het membraanmateriaal en de inhoud van het blaasje”, zegt Marc Siggel, een afgestudeerde student bij Max Planck, en een co-eerste auteur van de studie.
“Onze experimenten tonen aan dat met CNTP bezaaide liposomen de basis kunnen vormen voor het construeren van de langverwachte, maar tot dusver ongrijpbare, veelzijdige drager voor directe en zeer efficiënte afgifte van medicijnen en DNA- en RNA-vaccins door het plasmamembraan,” zei Noy.
“Deze strategie zou de endocytotische route volledig kunnen omzeilen en zo enkele van de problemen kunnen vermijden waarmee eerdere leveringsstrategieën werden geconfronteerd”, voegde Gerhard Hummer toe, een theoretisch biofysicus aan het Max Planck Institute, die de modelleringsinspanning leidde.
Nga T. Ho el al., “Membraanfusie en medicijnafgifte met koolstofnanobuisjes,” PNAS (2021). www.pnas.org/cgi/doi/10.1073/pnas.2016974118
Proceedings of the National Academy of Sciences
Geleverd door Lawrence Livermore National Laboratory