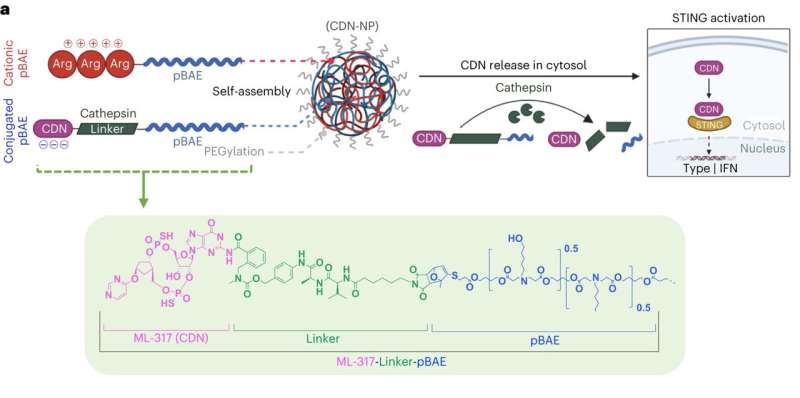
Synthese van CDN-geconjugeerde NP’s. Kationische pBAE’s worden geformuleerd door pBAE-polymeer met acrylaateindgroepen te mengen met arginine-oligopeptide (C6-CR3 genoemd). Met maleïmide gemodificeerd ML-317 wordt geconjugeerd aan pBAE door de Diels-Alder-reactie (ML-317-Linker-pBAE genoemd). Na CDN-conjugatie wordt ML-317-Linker-pBAE-polymeer elektrostatisch gecomplexeerd met C6-CR3-polymeer, resulterend in de vorming van covalent geconjugeerd CDN-NP. CDN-NP’s worden gePEGyleerd met behulp van NHS-PEG en gezuiverd en gesteriliseerd door filtratie. CDN wordt vrijgegeven uit de CDN-NP’s via een door cathepsine splitsbare linker in het celcytoplasma. Credit: Natuur Nanotechnologie (2023). DOI: 10.1038/s41565-023-01447-7
In de afgelopen tien jaar hebben onderzoekers gezocht naar effectievere en duurzamere kankerbehandelingen. Onder de grote verscheidenheid aan immunotherapieën is activering van de stimulator van interfron-genen (STING-agonisme) naar voren gekomen als een bijzonder veelbelovende benadering die het immuunsysteem van een patiënt gebruikt om tumoren door het hele lichaam te bestrijden.
Hoewel potentieel revolutionair, moeten er nog kritieke hindernissen worden overwonnen voordat STING-agonisme kan worden gebruikt als behandelingsoptie voor patiënten. De intraveneuze toediening van STING-agonisten is bijvoorbeeld vaak niet effectief vanwege een gebrek aan geneesmiddelstabiliteit en slechte opname door immuuncellen.
Om deze uitdagingen frontaal aan te pakken, hebben onderzoekers van Brigham and Women’s Hospital, een van de oprichters van het Mass General Brigham-gezondheidssysteem, nu op stimuli reagerende nanodeeltjesstructuren ontworpen, waardoor STING-agonist-medicijnen kunnen worden vrijgegeven wanneer ze de doelcellen bereiken. In een artikel dat vandaag is gepubliceerd in Natuur Nanotechnologiemelden de onderzoekers dat gestabiliseerde nanoformuleringen niet alleen actieve tumoren bij muizen uitroeiden, maar ook hun immuunsysteem trainden om toekomstige tumoren te herkennen en te elimineren.
“Ons doel is om STING-agonisme te gebruiken om het immuunsysteem te instrueren om kankercellen als indringers te behandelen, wat het ontwerp van stabiele en krachtige nanostructuren vereist die STING in staat stellen de juiste organen en de juiste cellen te bereiken,” zei senior auteur Natalie Artzi, Ph. .D., een hoofdonderzoeker bij de Brigham’s Department of Medicine.
Hoofdauteur Pere Dosta Pons, Ph.D., een instructeur in de Brigham’s Department of Medicine, benadrukte de nieuwigheid van hun aanpak: “We trainen niet alleen het immuunsysteem om kankercellen te targeten en te elimineren, maar ook om immuungeheugen te genereren voor het voorkomen van terugkeer van kanker.”
STING-agonisme omvat de activering van een eiwit dat de stimulator van interferon-genen (STING) wordt genoemd en dat het immuunsysteem waarschuwt voor de aanwezigheid van indringers. Wanneer het lichaam wordt geïnfecteerd door een virus of bacteriesoort, hechten kleine boodschappermoleculen, bekend als cytosolische cyclische dinucleotiden (CDN), zich aan STING. Deze activering stimuleert de productie van pro-inflammatoire cytokines, die op hun beurt immuuncellen activeren, zoals natural killer-cellen, macrofagen en T-cellen, en ze rekruteren naar het getroffen gebied om de infectie te verwijderen.
Kanker ontwijkt dit STING-pad door zichzelf te vermommen als lichaamseigen cellen. Onderzoekers hebben geprobeerd het immuunsysteem te leren kankercellen te identificeren en aan te vallen door STING-agonisten toe te dienen aan immuuncellen in de tumormicro-omgevingen en tumorafvoerende lymfeklieren.
In hun nieuwe paper beschrijft het Brigham-team een nieuwe nanodeeltjesstructuur die CDN-moleculen effectiever naar immuuncellen transporteert. Deze structuur verbindt in het laboratorium geproduceerde CDN’s rechtstreeks met nanodeeltjes gemaakt van poly (bèta-amino-esters) of pBAE’s, waardoor de verbinding stabieler en krachtiger wordt wanneer deze in het lichaam wordt geïnjecteerd, waardoor het therapeutische venster wordt vergroot. De nanostructuur taxiet de CDN-boodschappers rechtstreeks naar tumoren en maakt de lading alleen los wanneer ze de doelcellen bereiken.
Om de effectiviteit van hun aanpak te evalueren, diende het team de CDN-nanodeeltjes (CDN-NP) -verbindingen toe aan muizen met melanoom, darmkanker en borstkankertumoren. Ze bevestigden dat hun CDN-nanostructuren werden opgenomen door doelimmuuncellen in de micro-omgeving van de tumor en in secundaire lymfoïde organen, waardoor muizen langdurige immuniteit tegen toekomstige tumoren kregen. Toen overlevende muizen 60 dagen na hun eerste behandeling opnieuw met tumoren werden geïntroduceerd, waren ze in staat om de tumoren op eigen kracht af te stoten.
Het team ontwikkelde een reeks ontwerpregels waarmee rekening moet worden gehouden bij het toedienen van immuuntherapie, inclusief wat de rol is van secundaire lymfoïde organen bij het dicteren van therapeutische resultaten. Ze toonden aan dat de milt een cruciale rol speelt bij het coachen van het immuunsysteem om immuungeheugen te genereren.
Naast het aanpakken van fundamentele vragen over kanker en immunologie, tonen studies zoals deze het potentieel aan van het verbeteren van systemen voor het afleveren van gentherapie voor de behandeling van ziekten zoals kanker.
Bij het uitleggen van de betekenis van het werk zei Artzi: “Ons onderzoek richt zich op de fundamentele wisselwerking tussen het immuunsysteem en kanker door het gebruik van een nieuwe structuur die is ontworpen om zowel stabiel als krachtig te zijn. Bovendien hebben we aangetoond dat het richten op secundaire lymfoïde organen, zoals de milt, is cruciaal bij het genereren van een langdurige antitumorrespons, wat belangrijke implicaties heeft voor hoe we denken over de toediening van immunotherapie.”
Meer informatie:
Pere Dosta et al., Onderzoek naar de verbeterde antitumorkracht van STING-agonist na conjugatie aan polymere nanodeeltjes, Natuur Nanotechnologie (2023). DOI: 10.1038/s41565-023-01447-7
Tijdschrift informatie:
Natuur Nanotechnologie
Geleverd door Brigham en Women’s Hospital