Abstract. Credit: ACS Nano (2023). DOI: 10.1021/acsnano.2c09502
Beslissingen over de behandeling van kanker kunnen beter worden afgestemd op individuele patiënten met de goedkeuring van een nieuwe beeldvormingsmethode die wordt ontwikkeld door onderzoekers van de Universiteit van Michigan die de chemische samenstelling van de tumor van een patiënt in kaart brengt.
Tegenwoordig worden behandelmethoden voor kanker – of het nu gaat om chirurgie, bestralingstherapie of immunotherapie – aanbevolen, voornamelijk op basis van de locatie, grootte en agressiviteit van de tumor. Deze informatie wordt meestal verkregen door anatomische beeldvorming – MRI- of CT-scans of echografie en door biologische assays die worden uitgevoerd in weefsels die zijn verkregen door tumorbiopten.
Toch heeft de chemische omgeving van een tumor een significant effect op hoe effectief een bepaalde behandeling kan zijn. Een laag zuurstofgehalte in het tumorweefsel vermindert bijvoorbeeld de effectiviteit van bestralingstherapie.
Nu heeft een team van wetenschappers van de Universiteit van Michigan en twee universiteiten in Italië aangetoond dat een beeldvormingssysteem dat speciale nanodeeltjes gebruikt, een real-time chemische kaart met hoge resolutie kan bieden die de distributie van interessante chemicaliën in een tumor laat zien.
Het zou kunnen leiden tot een manier om clinici te helpen betere aanbevelingen te doen over kankertherapie die is toegesneden op een bepaalde patiënt: precisiegeneeskunde.
Hun onderzoek, gepubliceerd in ACS Nano, rapporteert over de eerste demonstratie van een in vivo chemische beeldvormingsmethode die kan worden gegeneraliseerd naar elke chemische stof die van belang is, volgens UM-professor scheikunde Raoul Kopelman, een van de senior auteurs van het artikel.
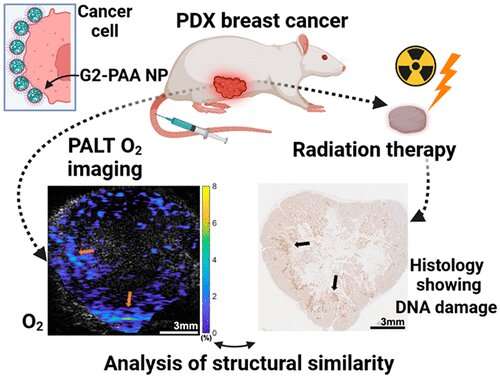
De onderzoekers gebruikten een methode voor “chemische beeldvorming” van weefsels, foto-akoestische chemische beeldvorming of PACI genoemd.
“De nieuwigheid van deze methode is dat het in vivo wordt uitgevoerd, direct in het lichaam,” zei Kopelman.
Het team testte hun systeem in muizen die waren geïmplanteerd met weefsel van een biopsie van de tumor van een patiënt, een zogenaamde xenograft. Van de patiënt afkomstige xenotransplantaten recapituleren de genetische en biologische kenmerken van de tumor van de patiënt.
PACI maakt gebruik van nanodeeltjes die in de afgelopen decennia zijn ontwikkeld door Kopelman en anderen, die in de muis kunnen worden geïnjecteerd om de tumor aan te pakken en een bepaalde chemische stof van biomedisch belang, zoals zuurstof, natrium of kalium, te detecteren.
Wanneer deze nanosensor wordt geactiveerd door infrarood laserlicht dat in staat is om door te dringen in het tumorweefsel, wordt een ultrasoon signaal gegenereerd dat kan worden gebruikt om de concentratie en verspreiding van die bepaalde chemische stof in kaart te brengen.
De PACI-methode zou kunnen worden gebruikt in een xenotransplantaat van een muis om herhaaldelijk de kenmerken van de tumor van een bepaalde patiënt te volgen om de chemische omgeving van de tumor in de loop van de tijd te evalueren.
“Dit zou de optimalisatie van behandelmethoden voor een bepaalde patiënt-precisiegeneeskunde mogelijk maken, ” zei Kopelman.
Kopelman en collega’s gebruikten de PACI met een nanodeeltje gericht op het detecteren van zuurstof. Na bestralingstherapie van de tumor in de muis vonden de onderzoekers een significante correlatie tussen zuurstofniveaus in elk deel van de tumor en hoe goed bestralingstherapie tumorweefsel vernietigde – hoe lager de lokale zuurstof in het weefsel, hoe lager de effectiviteit van de lokale bestralingstherapie. .
“We bieden dus een eenvoudige, niet-invasieve en goedkope methode om zowel de werkzaamheid van bestralingstherapie voor een bepaalde tumor te voorspellen als behandelingsresistente gebieden in de micro-omgeving van de tumor te identificeren, ” zei Kopelman.
“Een dergelijke chemische mapping zou het klinische team helpen een gepersonaliseerde, optimale behandeling voor de tumor van een bepaalde patiënt voor te schrijven, gebaseerd op de nieuwe diagnostiek van de chemische mapping van het tumorxenotransplantaat.”
In dit onderzoek is PACI gebruikt in van patiënten afkomstige xenotransplantaten. Het uiteindelijke doel zou de mogelijkheid zijn om de chemische kaarten rechtstreeks bij patiënten te maken.
Dat zou haalbaar zijn, zegt Kopelman, met glasvezel die door het veneuze systeem van de patiënt kan worden geleid, zoals wordt gedaan bij hartprocedures, om in de buurt van de tumor te komen. De nanosensor kan dan door de laser worden geactiveerd, maar daarvoor zijn nanosensoren nodig die zijn ontwikkeld voor elke chemische stof die van belang is, en elke nanosensor moet worden goedgekeurd door de Food and Drug Administration.
Meer informatie:
Janggun Jo et al, Personalised Oncology by In Vivo Chemical Imaging: fotoakoestische mapping van tumorzuurstof voorspelt de werkzaamheid van radiotherapie, ACS Nano (2023). DOI: 10.1021/acsnano.2c09502
Tijdschrift informatie:
ACS Nano
Aangeboden door de Universiteit van Michigan