Credit: Angewandte Chemie Internationale Editie (2023). DOI: 10.1002/anie.202310964
Eiwitsplitsende enzymen spelen een belangrijke rol in veel fysiologische processen. Dergelijke proteasen zijn doorgaans in een inactieve toestand aanwezig en worden alleen onder bepaalde omstandigheden geactiveerd. Sommige houden verband met ziekten zoals infecties of kanker, waardoor het belangrijk is om methoden te hebben die actieve proteasen selectief kunnen detecteren.
In een artikel gepubliceerd in het journaal Angewandte Chemie Internationale Editiehebben wetenschappers een nieuwe klasse protease-activiteitssensoren geïntroduceerd: gouden nanodeeltjes uitgerust met peptide-DNA.
Onder leiding van Devleena Samanta en Anna Capasso (de Universiteit van Texas in Austin, VS) heeft het team aangetoond dat deze nanosondes meerdere actieve proteasen parallel kunnen detecteren (multiplexmeting). De methode werkt bij kamertemperatuur en vereist geen ingewikkelde monstervoorbereiding of uitgebreide instrumenten.
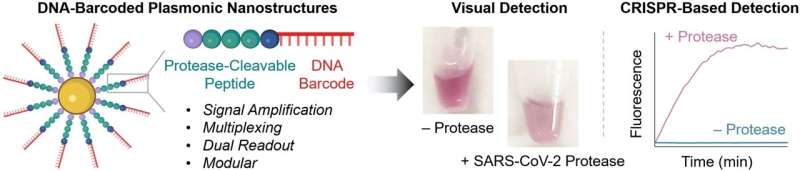
De kern van de nieuwe sondes bestaat uit gouden nanodeeltjes uitgerust met ketens gemaakt van een peptide en een DNA-fragment. De peptidestructuur is zo ontworpen dat deze wordt gesplitst door het gedetecteerde protease. Het DNA fungeert als een unieke streepjescode voor het identificeren van het peptide en versterkt ook het signaal. Als het gewenste protease in zijn actieve vorm in het monster aanwezig is, splitst het peptide het. Hierdoor komt de DNA-barcode vrij in de oplossing, waar deze kan worden gedetecteerd op basis van de volgorde ervan.
Om deze detectie uit te voeren, gebruikt het team een CRISPR/Cas12a-test: het enzym Cas12a wordt gebonden aan een gids-RNA (gRNA) om een inactief complex te vormen. Het gRNA bevat een segment dat specifiek bindt aan het barcode-DNA. Hierdoor wordt de Cas12a geactiveerd, zodat deze nu enkelstrengs DNA (ssDNA) kan ‘opknippen’.
Voor de test voegen de onderzoekers ssDNA-moleculen toe met aan de ene kant een fluorescerende groep (fluorofoor) en aan de andere kant een quencher, die de fluorescentie van de fluorofoor “uitschakelt” (zolang ze dichtbij genoeg zijn). Als het ssDNA wordt opgeknipt, bewegen de fluorofoor en de quencher verder uit elkaar. Dit resulteert in een sterke fluorescentie die aangeeft dat het protease waarop wordt getest aanwezig is (detectielimiet van ongeveer 58 pM).
Als er ter plaatse geen instrumenten beschikbaar zijn en de test snel moet verlopen, is detectie met het blote oog mogelijk: als het protease het peptide op de sonde splitst, verandert de oppervlaktelading van de gouden nanodeeltjes en aggregeren ze. De kleur van deze zogenaamde “plasmonische nanostructuren” hangt in belangrijke mate af van hun mate van aggregatie. Het is mogelijk om nanomolaire proteaseconcentraties te detecteren op basis van de kleurverandering in de testoplossing.
Dankzij multiplexdetectie van de proteasen 3CL en caspase3 kon het team de hoge gevoeligheid en selectiviteit van hun nieuwe methode aantonen. 3CL is een marker voor actieve coronavirusinfectie en COVID-patiënten hebben vaak ook een verhoogde activiteit van de apoptosemarker caspase3. Het klinische potentieel van deze test werd ook aangetoond door de detectie van cathepsine B, een protease gerelateerd aan colorectale kanker, in drie verschillende tumorcellijnen verkregen van patiënten.
Deze nanosondes leveren 100 maal hogere fluorescentiesignalen op in vergelijking met commerciële op fluorescentie gebaseerde proteasesensoren. Bovendien kan vrijwel elk protease worden gedetecteerd als het peptide dat het splitst bekend is. Alles bij elkaar kunnen deze nanosondes mogelijk vroegtijdige ziektedetectie mogelijk maken en de precisie en betrouwbaarheid van diagnostische tests verbeteren door middel van multiplexing.
Meer informatie:
Subrata Pandit et al, DNA-gebarcodeerde plasmonische nanostructuren voor activiteitsgebaseerde proteasedetectie, Angewandte Chemie Internationale Editie (2023). DOI: 10.1002/anie.202310964
Tijdschriftinformatie:
Angewandte Chemie Internationale Editie
Geleverd door Wiley