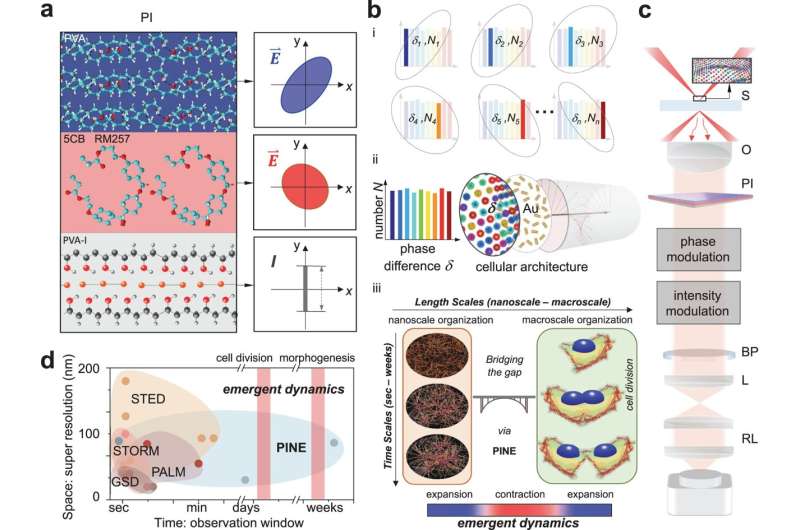
Principe van de niet-blekende fase-intensiteit nanoscoop, PINE, voor levende materie. A Fase-intensiteit PI: Geïntegreerde fase-intensiteit meerlaagse dunne film bestaande uit polyvinylalcohol/vloeibare kristallijne polymeren, maakt nauwkeurige regeling van faseverschillen tussen elektrische veldcomponenten mogelijk. Verstrooid licht wordt hervormd volgens fasemodulatie. Fasemodulatie wordt vervolgens omgezet in intensiteitsmodulatie, zodat de resulterende intensiteitsvariatie overeenkomt met subsets van nanosondes die cellulaire architecturen labelen. B Concept van PINE: (i) PI moduleert nauwkeurig faseverschillen δN overeenkomend met subsets van nanosondes NN binnen de bevolking. N: aantal nanosondes. δ: faseverschil tussen elektrische veldcomponenten. (ii) Willekeurig verdeelde nanoprobes (Au nanorods) vormen patronen van de onderliggende cellulaire architecturen. Met behulp van PI vertonen nanosondes op een stochastische manier faseverschillen tussen elektrische veldcomponenten. (iii) PINE opent een langdurig onderzoeksvenster om de opkomende dynamiek van nanoschaal naar macroschaal te onderzoeken: bij celdeling komt reorganisatie van individuele bestanddelen op nanoschaal in de loop van de tijd naar voren in bewegingen op groepsniveau en vormveranderingen op macroschaal. C Opgericht. Darkfield-configuratie verlicht een met een nanosonde gelabeld monster (S) in een temperatuur- en gasgestuurde stroomkamer. Het verzamelde verstrooide licht door objectief (O) is fase-intensiteit gemoduleerd (PI) en banddoorlaat gefilterd (BP). Om de vergroting van het systeem te vergroten, werden relaislenzen (RL) toegevoegd om de effectieve brandpuntsafstand van de buislens (L) te vergroten. Na fase-intensiteitsscheiding komt de resulterende intensiteitsvariatie overeen met subsets van nanosondes. D Superresolutiemethoden voor fluorescentie, zoals grondtoestanddepletie (GSD), gestimuleerde emissiedepletie (STED), foto-geactiveerde lokalisatiemicroscopie (PALM) en stochastische optische reconstructiemicroscopie (STORM), hebben de ruimtelijke resolutie tot voorbij de diffractielimiet geduwd (y -as) (volledige tabel in ondersteunende informatie Fig. S1). PINE creëert nieuwe nanoscopische mogelijkheden langs de tijdas (x-as) voor onderzoeken die langdurige observatievensters vereisen. Credit: Natuurcommunicatie (2023). DOI: 10.1038/s41467-023-39624-w
Een nieuwe manier om details te zien die kleiner zijn dan de helft van de golflengte van licht, heeft onthuld hoe scaffolding op nanoschaal in cellen overbrugt naar de macroschaal tijdens celdeling. In tegenstelling tot eerdere superresolutietechnieken, vertrouwt degene die is ontwikkeld en getest aan de Universiteit van Michigan niet op moleculen die verslijten bij langdurig gebruik.
Superresolutie kan structuren tot 10 nanometer onthullen, of ongeveer dezelfde breedte als 100 atomen. Het opende een hele nieuwe wereld in de biologie, en de technieken die dit voor het eerst mogelijk maakten, ontvingen in 2014 een Nobelprijs. Het zwakke punt is echter dat het slechts momentopnamen van tientallen seconden kan maken. Dit maakt het onmogelijk om de evolutie van de machinerie van een cel gedurende lange perioden waar te nemen.
“We vroegen ons af: wanneer het systeem als geheel zich deelt, hoe interageren structuren op nanometerschaal dan met hun buren op nanometerschaal, en hoe schaalt deze interactie op naar de hele cel?” vroeg Somin Lee, assistent-professor elektrotechniek en computertechniek aan de UM, die de studie leidde waarin werd gepubliceerd Natuurcommunicatie.
Om die vraag te beantwoorden, hadden Lee en collega’s een nieuw soort superresolutie nodig. Met hun nieuwe methode konden ze een cel 250 uur lang continu monitoren.
“De levende cel is een drukke plaats met hier en daar bruisende eiwitten. Onze superresolutie is erg aantrekkelijk om deze dynamische activiteiten te bekijken”, zegt Guangjie Cui, een Ph.D. student in elektrische en computertechniek en co-eerste auteur van de studie met Yunbo Liu, een Ph.D. afgestudeerd in elektrotechniek en informatica.
Net als de oorspronkelijke methode, gebruikt de nieuwe techniek sondes in de buurt van de interessante objecten op nanoschaal om er licht op te werpen. Superresolution 1.0 gebruikte hiervoor fluoroforen, fluorescerende moleculen die een antwoordlicht zouden uitzenden nadat ze waren belicht. Als de fluoroforen dichter bij elkaar waren dan de grootte van wat er werd afgebeeld, zou het beeld kunnen worden gereconstrueerd uit de lichtflitsen die door de fluoroforen worden geproduceerd.
De nieuwe techniek maakt gebruik van gouden nanostaafjes, die niet afbreken bij herhaalde blootstelling aan licht, maar gebruik maken van het licht dat ermee in wisselwerking staat, is een grotere uitdaging. Nanostaafjes reageren op de fase van het licht, of waar het zich bevindt in de op-en-neergaande oscillatie van de elektrische en magnetische velden waaruit het bestaat. Deze interactie hangt af van hoe de nanostaaf onder een hoek staat ten opzichte van het invallende licht.
Net als de fluoroforen kunnen de nanostaafjes zich hechten aan bepaalde celstructuren met gerichte moleculen op hun oppervlak. In dit geval zochten de nanostaafjes actine op, een eiwit dat structuur toevoegt aan zachte cellen. Actine heeft de vorm van vertakte filamenten, elk ongeveer 7 nanometer (miljoenste millimeter) in diameter, hoewel ze met elkaar verbonden zijn om duizenden nanometers te overspannen. Hoewel de nanostaafjes vaak meer dan tweemaal de diameter van de actine hebben, kunnen de gegevens die ze als groep leveren, de kleine details ervan verhelderen.
Om de nanostaafjes te lokaliseren, bouwde het team filters gemaakt van dunne lagen polymeren en vloeibare kristallen. Deze filters maakten de detectie van licht met een bepaalde fase mogelijk, waardoor het team nanostaafjes kon uitkiezen met bepaalde hoeken ten opzichte van het invallende licht. Door 10-30 foto’s te maken – elk kijkend naar een andere subset van nanostaafjes – en ze samen te voegen tot één beeld, kon het team de details op nanometerschaal van de filamenten in de cellen afleiden. Deze details zouden vervaagd zijn in conventionele microscopen.
Met behulp van de techniek ontdekte het team drie regels die bepalen hoe actine zichzelf organiseert tijdens celdeling:
- Actine zet uit om zijn buren te bereiken wanneer actinefilamenten ver uit elkaar liggen.
- Actin zal dichter bij zijn buren komen om de verbindingen te vergroten, hoewel deze neiging wordt getemperd door de drang om uit te breiden en meer buren te bereiken.
- Als gevolg hiervan heeft het actine-netwerk de neiging om samen te trekken wanneer het meer verbonden is, en zal het uitzetten wanneer het minder verbonden is.
Het gedrag van de actine is verbonden met het gedrag van de cel, maar de cel trekt samen wanneer de actine uitzet en zet uit wanneer de actine samentrekt. Het team wil dit verder onderzoeken en ontdekken waarom de bewegingen op verschillende schalen tegengesteld zijn. Ze willen ook onderzoeken wat de gevolgen zijn van het ontregelen van dit moleculaire proces: ligt dit aan de basis van sommige ziekten?
Meer in het algemeen hopen ze superresolutie te gebruiken om te begrijpen hoe zelforganisatie is ingebouwd in biologische structuren, zonder de noodzaak van centrale controle.
“Onze genetische code bevat eigenlijk niet genoeg informatie om elk detail van het organisatieproces te coderen”, zei Lee. “We willen de mechanismen van collectief gedrag verkennen zonder centrale coördinatie, zoals vogels die in formatie vliegen – waarin het systeem wordt aangedreven door interacties tussen individuele onderdelen.”
Meer informatie:
Guangjie Cui et al, Phase intensity nanoscope (PINE) opent langdurige onderzoeksvensters van levende materie, Natuurcommunicatie (2023). DOI: 10.1038/s41467-023-39624-w
Tijdschrift informatie:
Natuurcommunicatie
Aangeboden door de Universiteit van Michigan