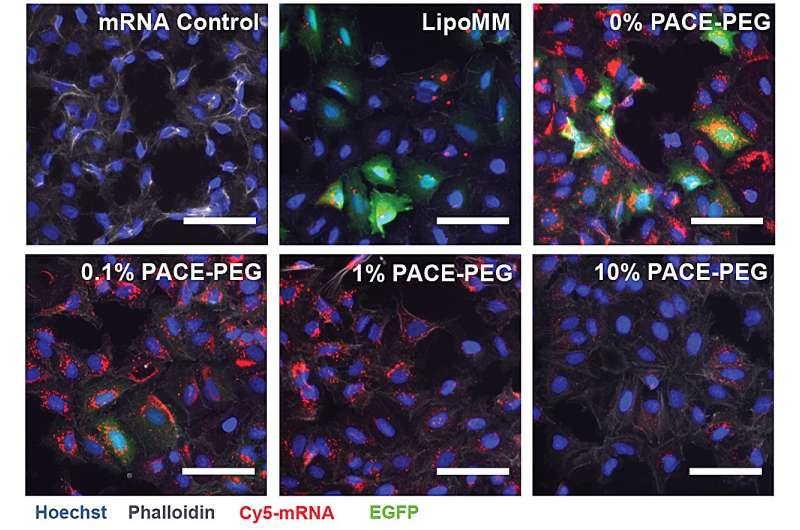
Opname en eiwitexpressie na aflevering van PACE-mRNA in A549-cellen. Krediet: Suberi et al., Sci. Vert. Med. 15, eabq0603 (2023)
Onderzoekers van Yale University, New Haven, hebben een op polymeren gebaseerd mRNA-vehikel geoptimaliseerd voor gerichte longafgifte en hebben het potentieel aangetoond van het platform voor mucosale vaccinatie tegen respiratoire pathogenen.
In een paper, “Polymeer nanodeeltjes leveren mRNA aan de longen voor mucosale vaccinatie”, gepubliceerd in Wetenschap Translationele geneeskundeintroduceert het team hun creatie van inhaleerbaar messenger RNA (mRNA) voor therapeutisch gebruik.
Klinisch onderzoek heeft gezocht naar een efficiënte en gerichte manier om mRNA naar de longen te brengen voor verschillende therapeutische toepassingen, waaronder eiwitvervangende therapieën, genbewerking en vaccinatie. De belangrijkste uitdagingen waren het handhaven van de mRNA-stabiliteit en het vermijden van immuuninterferentie.
Het Yale-team creëerde PACE-polymeerformuleringen (Polymerized Albumin Conjugates for mRNA Encapsulation) om lokaal mRNA naar de longen te brengen. De onderzoekers optimaliseerden PACE-polyplexen om mRNA-bescherming, transfectie-efficiëntie en antigeenpresentatie te verbeteren voor effectieve longspecifieke therapeutische en vaccinatiestrategieën.
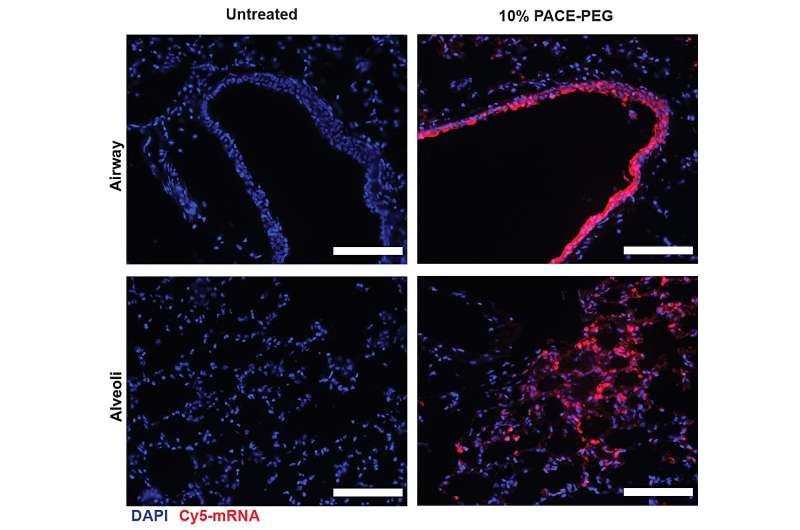
Biodistributie van PACE-mRNA in de longen na levering aan muizen. Krediet: Suberi et al., Sci. Vert. Med. 15, eabq0603 (2023)
Om PACE te stabiliseren, werd tijdens het enzymatische copolymerisatieproces een geoptimaliseerde verhouding van polyethyleenglycol (PEG)-moleculen in de polymeerstructuur geïntegreerd, waardoor de polyplexen werden gestabiliseerd en belangrijke kenmerken werden gewijzigd. PEG was in staat om de grootte, oppervlaktelading en andere eigenschappen van de polyplexen te beïnvloeden, waardoor ze geschikter werden om te laden en effectiever waren bij het afleveren van mRNA aan longcellen.
De gestabiliseerde formulering presteerde slecht in een in vitro celkweekexperiment. De onderzoekers merken op dat traditionele celkweekmethoden geen goede voorspellers zijn van leveringssystemen, zowel positief als negatief. De omgeving in het lichaam, vooral de longen, werkt heel anders samen dan een verzameling cellen. De slijmvliesoppervlakken ontbreken bijvoorbeeld, en die oppervlakken zijn precies waarvoor het PACE-PEG-systeem ontworpen is. De echte test zou in vivo komen met een muismodel.
De onderzoekers kapselden mRNA in dat codeert voor het spike-eiwit van SARS-CoV-2 in PACE en inoculeerden muizen die vatbaar waren voor SARS-CoV-2-infectie. Muizen kregen een dosis van 10 μg PACE-mRNA intranasaal toegediend op dag 0 en 28. De ontwikkeling van adaptieve immuniteit in de mediastinale lymfeklieren werd 14 dagen na de boost getest en bevestigd.
Na beoordeling van de lokale immuunrespons onderzochten de onderzoekers longweefsels, bloedserum en bronchoalveolaire lavagevloeistof op lokale en systemische antigeenspecifieke T-cel- en antilichaamresponsen. Transfectie vond voornamelijk plaats in longepitheelcellen en antigeenpresenterende cellen, twee celtypen die relevante doelwitten zijn voor longziekten
De vaccinatie verhoogde met succes het spike-eiwitspecifieke CD8+ T-cellen in het longweefsel en circulerende CD8+ T-cellen in de bloedbaan. CD8+ T-cellen brachten markers tot expressie die indicatief zijn voor geheugen in het weefsel. Zowel circulerende als mucosale IgG-antilichamen werden gevonden in significant hogere concentraties in gevaccineerde muizen.
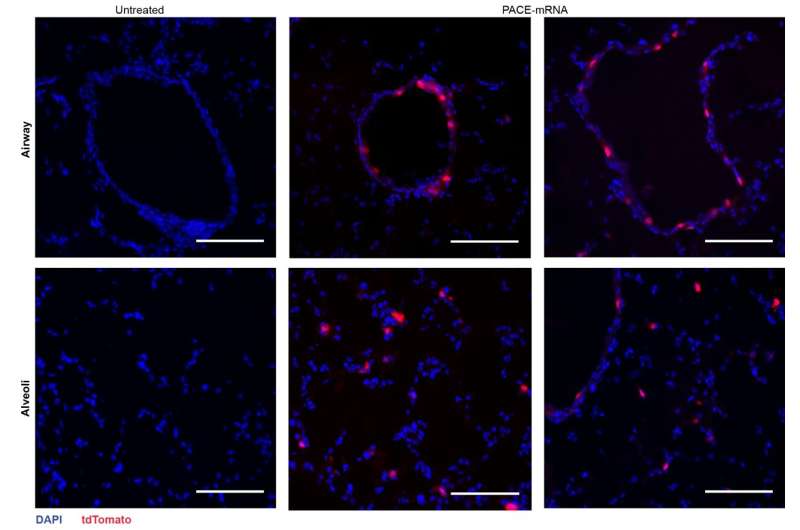
Eiwitexpressie in de longen na afgifte van PACE-mRNA aan muizen. Krediet: Suberi et al., Sci. Vert. Med. 15, eabq0603 (2023)
Vervolgens kregen muizen een dodelijke dosis SARS-CoV-2 toegediend. PACE-mRNA-vaccinatie verminderde significant de virale last in de longen en verbeterde het gewicht en de overleving van de gevaccineerde muizen. Deze bescherming werd toegeschreven aan de spike-eiwitspecifieke immuunrespons die door de vaccinatie werd geïnduceerd.
De controlegroep vertoonde geen bewijs van een spike-eiwitspecifieke immuunrespons en vertoonde geen verminderde virale belasting of verbeterde overleving na de virale challenge.
De studie presenteert PACE-mRNA-polyplexen als een veelbelovende methode voor efficiënte en gerichte mRNA-afgifte aan de longen met potentiële voordelen voor zowel therapeutische eiwitexpressie als mucosale vaccinatie tegen respiratoire pathogenen.
De studie illustreert ook het belang van diermodellen, in tegenstelling tot celkweek alleen, bij het bepalen van effecten in de echte wereld. De positieve resultaten geven aan dat meer onderzoek gerechtvaardigd is, met verdere tests gepland op grotere diermodellen.
Meer informatie:
Alexandra Suberi et al, Nanodeeltjes van polymeer leveren mRNA aan de long voor mucosale vaccinatie, Wetenschap Translationele geneeskunde (2023). DOI: 10.1126/scitranslmed.abq0603
Tijdschrift informatie:
Wetenschap Translationele geneeskunde