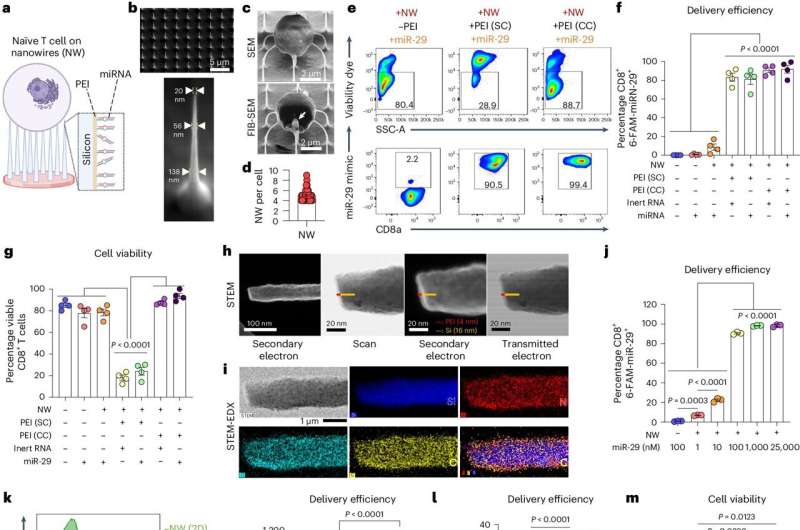
Gefunctionaliseerde nanodraden leveren miRNA aan naïeve CD8+ T-cellen van muizen met een hoge levensvatbaarheid en leveringsefficiëntie. Credit: Natuur Nanotechnologie (2024). DOI: 10.1038/s41565-024-01649-7
Adoptieve T-celtherapie heeft een revolutie teweeggebracht in de geneeskunde. De T-cellen van een patiënt – een soort witte bloedcel die deel uitmaakt van het immuunsysteem van het lichaam – worden in een laboratorium geëxtraheerd en gemodificeerd en vervolgens weer in het lichaam ingebracht, om infecties of kankercellen op te sporen en te vernietigen.
Nu hebben Georgia Tech-bio-ingenieur Ankur Singh en zijn onderzoeksteam een methode ontwikkeld om deze baanbrekende immunotherapie te verbeteren.
Hun oplossing bestaat uit het gebruik van nanodraden om therapeutisch miRNA aan T-cellen af te leveren. Dit nieuwe modificatieproces behoudt de naïeve toestand van de cellen, wat betekent dat ze nog betere ziektebestrijders zullen zijn als ze opnieuw in een patiënt worden ingebracht.
“Door miRNA in naïeve T-cellen af te leveren, hebben we feitelijk een infanterie voorbereid die klaar is om ingezet te worden,” zei Singh. “En wanneer deze naïeve cellen worden gestimuleerd en geactiveerd in aanwezigheid van een ziekte, is het alsof ze in samoerais zijn veranderd.”
Snel en gevaarlijk
Momenteel worden bij adoptieve T-celtherapie de cellen in het laboratorium gestimuleerd en gepreactiveerd wanneer ze worden gemodificeerd, waardoor hun naïeve toestand verloren gaat. Singh’s nieuwe techniek overwint deze beperking. De aanpak wordt beschreven in een nieuwe studie gepubliceerd in het journaal Natuur Nanotechnologie.
“Naïeve T-cellen zijn nuttiger voor immunotherapie omdat ze nog niet vooraf zijn geactiveerd, wat betekent dat ze gemakkelijker kunnen worden gemanipuleerd om de gewenste therapeutische functies over te nemen”, zegt Singh, hoogleraar Carl Ring Family aan de Woodruff School of Mechanical Engineering en de Wallace H. Coulter Afdeling Biomedische Technologie.
De ruwe rekruten van het immuunsysteem, naïeve T-cellen, zijn witte bloedcellen die nog niet in de strijd zijn getest. Maar deze mobiele rekruten zijn robuust, beïnvloedbaar en aanpasbaar – klaar en enthousiast om te programmeren.
“Dit proces creëert een goed geprogrammeerde naïeve T-cel, ideaal voor het versterken van de immuunreacties tegen specifieke doelwitten, zoals tumoren of ziekteverwekkers”, zegt Singh.
De precieze programmering die naïeve T-cellen ontvangen, vormt de basis voor een succesvollere toekomst in de strijd tegen ziekten, vergeleken met voorgeactiveerde cellen.
Gevechtscellen een boost geven
In het lichaam worden naïeve T-cellen geactiveerd wanneer ze een gevaarsignaal ontvangen van antigenen, die deel uitmaken van ziekteverwekkende pathogenen, maar ze sturen een signaal naar T-cellen die het immuunsysteem activeren.
Adoptieve T-celtherapie wordt gebruikt tegen agressieve ziekten die het afweersysteem van het lichaam overweldigen. Wetenschappers geven de T-cellen van de patiënt een therapeutische boost in het laboratorium, vullen ze aan met extra medicijnen en preactiveren ze chemisch.
Dat is wanneer de cellen hun naïeve staat verliezen. Wanneer deze gemodificeerde T-cellen opnieuw in de patiënt worden geïnjecteerd, vormen ze een effectieve infanterie tegen ziekten, maar ze lopen de neiging uitgeput te raken. Het zijn geen samoerai. Naïeve T-cellen zouden dat echter wel kunnen zijn, als jonge, programmeerbare rekruten die ze zijn.
De vraag voor Singh en zijn team was: hoe geven we cellen die therapeutische boost zonder ze vooraf te activeren, waardoor ze die ongerepte, zeer suggestieve naïeve staat verliezen? Hun antwoord: nanodraden.
NanoPrecision: de gerichte oplossing
Singh wilde naïeve T-cellen versterken met een dosis miRNA. miRNA is een molecuul dat, wanneer het als therapeutisch middel wordt gebruikt, werkt als een soort volumeknop voor genen, waardoor hun activiteit hoger of lager wordt gezet om infecties en kanker onder controle te houden. Het miRNA voor deze studie werd gedeeltelijk ontwikkeld door de co-auteur van de studie, Andrew Grimson van Cornell University.
“Als we een manier zouden kunnen vinden om de cellen met geweld binnen te dringen zonder ze te beschadigen, zouden we ons doel kunnen bereiken om het miRNA in naïeve T-cellen af te leveren zonder ze vooraf te activeren”, legt Singh uit.
Traditionele modificatie in het laboratorium omvat het binden van immuunreceptoren aan T-cellen, waardoor de opname van miRNA of ander genetisch materiaal mogelijk wordt (wat resulteert in het verlies van de naïeve toestand). “Maar nanodraden maken geen gebruik van receptoren en activeren dus geen cellen, dus behouden ze hun naïeve staat”, zei Singh.
De nanodraden, siliciumwafeltjes gemaakt met speciaal gereedschap van het Georgia Tech Institute for Electronics and Nanotechnology, vormen een fijn naaldbed. Cellen worden op de nanodraden geplaatst, die gemakkelijk de cellen binnendringen en hun miRNA gedurende enkele uren afgeven. Vervolgens worden de cellen met miRNA uit de toppen van de nanodraden gespoeld, geactiveerd en uiteindelijk terug in de patiënt geïnjecteerd. Deze geprogrammeerde cellen kunnen vijanden gedurende een langere periode efficiënt doden.
“Wij geloven dat deze aanpak een echte gamechanger zal zijn voor adoptieve immuuntherapieën, omdat we nu het vermogen hebben om T-cellen te produceren met een voorspelbaar lot”, zegt Brian Rudd, hoogleraar immunologie aan de Cornell University, en co-senior auteur van de studie. met Singh.
De onderzoekers testten hun werk voor deze studie in twee afzonderlijke diermodellen voor infectieziekten in Cornell, en Singh beschreef de resultaten als “een robuuste prestatie op het gebied van infectiebeheersing.”
In de volgende fase van het onderzoek zullen de onderzoekers de lat hoger leggen, van infectieziekten naar het testen van hun cellulaire supersoldaten tegen kanker en richting vertaling naar de klinische setting.
Meer informatie:
Kristel J. Yee Mon et al, Gefunctionaliseerde nanodraden voor miRNA-gemedieerde therapeutische programmering van naïeve T-cellen, Natuur Nanotechnologie (2024). DOI: 10.1038/s41565-024-01649-7
Tijdschriftinformatie:
Natuur Nanotechnologie
Geleverd door Georgia Institute of Technology
