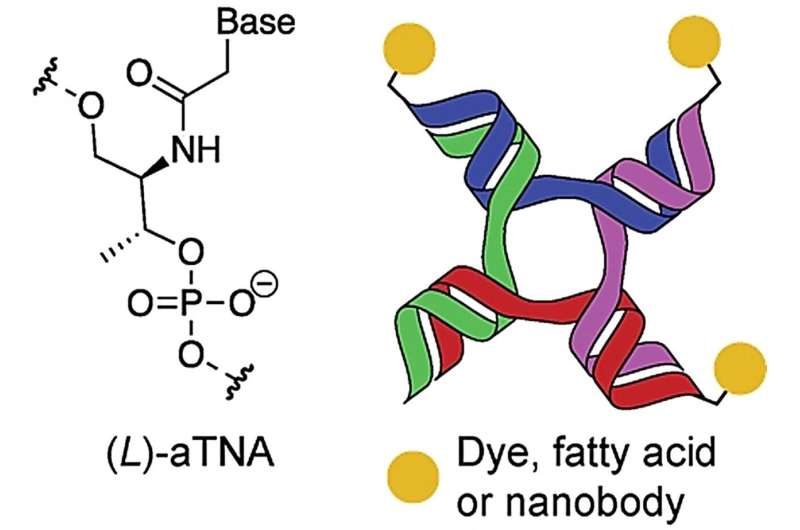
Onderzoekers van de Universiteit van Aarhus hebben een manier gevonden om stabielere nanostructuren te creëren die biomoleculen met verschillende functies kunnen binden en assembleren, die in combinatie bijvoorbeeld een effectiever kankermedicijn kunnen bieden. De illustratie komt uit het wetenschappelijke artikel in Angewandte Chemie Int. Ed., waarin schematisch de nanostructuur wordt weergegeven die wordt gebruikt met ketens van de kunstmatige bouwsteen, acyclisch L-threoninol-nucleïnezuur (aTNA). Krediet: Anw. Chem.Int. Ed.
DNA speelt al duizenden jaren een centrale rol bij het opslaan van de genetische informatie van elke cel en bestaat uit strengen met een specifieke volgorde van vier verschillende bouwstenen. Deze DNA-strengen worden door de cel bij elke celdeling op een buitengewoon goed georkestreerde manier gekopieerd, maar verbazingwekkend genoeg wordt dit geavanceerde mechanisme beheerst door zeer eenvoudige regels.
In de afgelopen jaren is gebleken dat deze eenvoudige regels niet alleen worden gebruikt in de context van genetische manipulatie, maar ook om bruikbare DNA-nanostructuren te construeren door DNA-strengen te ontwerpen. Van deze DNA-nanostructuren is aangetoond dat ze een aantal nuttige biomedische functies hebben, zoals het kunnen transporteren van kankermedicijnen naar de exacte plaatsen in het lichaam waar ze nodig zijn. Dit kan het effect van de medicatie vergroten en zorgen voor minder bijwerkingen in vergelijking met conventionele kankerbehandeling.
DNA-nanostructuren worden ook steeds vaker gebruikt als hulpmiddel om biomoleculen te binden en te assembleren tot multifunctionele structuren. Een van deze gebruikte DNA-nanostructuren vormt een vertakte structuur met vier uiteinden, de zogenaamde 4-way junctions (4WJ), die ook van nature voorkomen.
Met speciaal ontworpen versies van deze 4WJ-structuren is het bijvoorbeeld Harvard Medical School in Boston gelukt om verschillende antilichamen te binden en te verzamelen, die er in combinatie voor zorgden dat T-cellen agressieve kankercellen intensiever aanvielen en zo tumoren doodden.
Verbeterde DNA-nanostructuren met kunstmatige bouwstenen
Onderzoekers die deel uitmaken van het Center for Multifunctional Biomolecular Drug Design (CEMBID) aan de Universiteit van Aarhus, werken ook aan het vinden van nieuwe manieren om verschillende medicijnen aan elkaar te koppelen om meer en effectievere werkingsmechanismen te bereiken. De onderzoeksgroep, onder leiding van professor Kurt Gothelf, heeft zojuist een artikel in het tijdschrift gepubliceerd Angewandte Chemie Int. Ed. met resultaten met bovengenoemde 4WJ-structuren, maar in een verbeterde versie. Het werk werd uitgevoerd in samenwerking met de groepen van Jørgen Kjems en Ken Howard die ook deel uitmaken van CEMBID.
Toegegeven, deze DNA-nanostructuren (4WJ) zijn slim, maar het nadeel van DNA-structuren is dat DNA de facto een biologisch afbreekbaar polymeer is. Hierdoor worden de structuren in het bloed sneller afgebroken dan gewenst. Bovendien kunnen de structuren zo groot zijn dat ze zelf het immuunsysteem activeren. Om de structuren te kunnen gebruiken voor diagnostiek of in de geneeskunde, is het cruciaal dat de structuren zeer stabiel, niet-toxisch zijn en zelf geen immuunreactie bij de patiënt veroorzaken.
Anders Märcher, een postdoc in de onderzoeksgroep van Kurt Gothelf en onderdeel van CEMBID, heeft nu samen met zijn onderzoekscollega’s een manier gevonden om de stabiliteit van deze nanostructuren te vergroten. Ze hebben dit bereikt door kleine ketens, oligonucleotiden genaamd, van kunstmatige en gemodificeerde bouwstenen te gebruiken om de nanostructuur te vormen. De kunstmatige oligonucleotiden, Märcher et al. gebruik heet acyclisch L-threoninol nucleïnezuur (aTNA) en werkt op dezelfde manier en net zo goed als de natuurlijke bouwstenen van DNA. Hierbij wordt het suikermolecuul (deoxyribose) in de natuurlijke bouwstenen vervangen door een kunstmatig suikermolecuul (acyclische L-threoninol), wat de algehele structuur versterkt.
De positieve resultaten toonden aan dat 4WJ-structuren met de kunstmatige bouwsteen, aTNA, zeer stabiel zijn, niet degraderen in het bloed, niet-toxisch zijn voor cellen en geen niet-specifieke immuunrespons opwekken. Toen de onderzoekers een bepaald type biomolecuul, waarvan bekend is dat het bindt aan een biomarker in borstkankercellen met hoge specificiteit, koppelden aan de nieuwe 4WJ-structuur, bleek dat de 4WJ-structuur effectief kan zijn bij het sturen van kankermedicijnen naar de gewenste cellen. . Door verdere aanpassingen aan de nieuwe 4WJ-structuur aan te brengen, zouden ze bovendien de levensduur in de bloedbaan kunnen verlengen en dus ook het effect van het medicijn dat mogelijk is gekoppeld aan de DNA-nanostructuur.
De onderzoekers stellen zich voor dat hun 4WJ-structuur, gebouwd met kunstmatige bouwstenen, zowel kan worden gebruikt als een hulpmiddel om medicijnen naar de juiste positie in het lichaam van een patiënt te transporteren. Daarnaast zien ze dat het een waardevol hulpmiddel kan zijn bij onderzoek. Zo stellen onderzoekers zich voor dat de effecten van verschillende combinaties van kankerafbrekende biomoleculen sneller en efficiënter gescreend kunnen worden, zodat de meest effectieve kankerbehandeling sneller gevonden kan worden.
Anders Märcher et al, Functionalized Acyclic (l)‐Threoninol Nucleic Acid Four-Way Junction met hoge stabiliteit in vitro en in vivo, Internationale editie van Angewandte Chemie (2022). DOI: 10.1002/anie.202115275
Internationale editie van Angewandte Chemie
Geleverd door de Universiteit van Aarhus