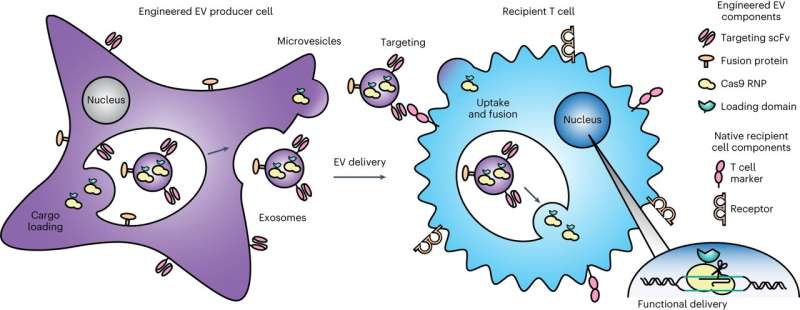
Overzicht van de GEMINI-strategie voor het genetisch manipuleren van multifunctionele EV’s. EV-vrachteiwitten worden tot expressie gebracht in productiecellen om opname in meerdere blaasjespopulaties te vergemakkelijken: MV’s, die uit het celoppervlak ontluiken, of exosomen, die worden geproduceerd door endosomale invaginaties in multivesiculaire lichamen. Op het oppervlak weergegeven targeting- en fusie-eiwitten helpen bij de binding aan en opname door ontvangende cellen en de daaropvolgende vrijgave van lading via celoppervlakfusie of endosomale ontsnapping. In de proof-of-principle-toepassing die in deze studie wordt onderzocht, is het doel om een Cas9-sgRNA-complex aan T-cellen af te leveren om een gen uit te schakelen. Credit: Natuur Biomedische Technologie (2023). DOI: 10.1038/s41551-023-01142-x. https://www.nature.com/articles/s41551-023-01142-x
De afgelopen jaren zijn cel- en gentherapieën veelbelovend gebleken voor de behandeling van kanker, cystische fibrose, diabetes, hartziekten, HIV/AIDS en andere moeilijk te behandelen ziekten. Maar het gebrek aan effectieve manieren om biologische behandelingen in het lichaam toe te passen heeft een grote barrière gevormd voor het op de markt brengen van deze nieuwe therapieën – en uiteindelijk voor de patiënten die ze het meest nodig hebben.
Nu hebben synthetische biologen van de Northwestern University een flexibel nieuw platform ontwikkeld dat een deel van dit lastige leveringsprobleem oplost. Het toedieningssysteem bootst de natuurlijke processen na die door virussen worden gebruikt en bindt zich aan doelcellen en brengt op effectieve wijze medicijnen naar binnen over.
De werkpaarden achter dit nieuwe platform zijn extracellulaire blaasjes (EV’s) – kleine nanodeeltjes ter grootte van een virus die alle cellen op natuurlijke wijze al produceren. In de nieuwe studie gebruikten onderzoekers de krachtige aanpak van synthetische biologie om DNA-‘programma’s’ te bouwen die – wanneer ze in ‘producent’-cellen worden ingebracht – deze cellen ertoe aanzetten om zelf aangepaste EV’s met nuttige oppervlaktekenmerken te assembleren. De programma’s sturen cellen ook aan om de EV’s te produceren en te laden met biologische medicijnen.
In proof-of-concept-experimenten hebben de deeltjes met succes biologische medicijnen afgeleverd – in dit geval CRISPR-geneeditors die een receptor uitschakelen die door HIV wordt gebruikt – naar T-cellen, die notoir moeilijk te targeten zijn. De onderzoekers veronderstellen ook dat het systeem voor veel medicijnen en veel soorten cellen zou moeten werken.
De onderzoek werd gepubliceerd vandaag (27 november) in het tijdschrift Natuur Biomedische Technologie. Het is het eerste onderzoek waarin EV’s met succes worden ingezet om vracht in T-cellen af te leveren.
“De genomica-revolutie heeft ons begrip van de moleculaire basis van veel ziekten getransformeerd, maar deze inzichten hebben om één fundamentele reden niet geresulteerd in nieuwe medicijnen: het ontbreekt ons aan de technologie die nodig is om gerichte medicijnen af te leveren op specifieke plaatsen in het lichaam waar ze nodig zijn, ‘ zei Joshua N. Leonard van Northwestern, die het onderzoek leidde.
“Deze uitdagingen op het gebied van gedeelde levering houden ons tegen. Door brede leveringsplatforms beschikbaar te stellen, kunnen we een groot deel van de risico’s en kosten wegnemen die gepaard gaan met het op de markt brengen van nieuwe geneesmiddelen in klinische onderzoeken of op de markt. In plaats van telkens een nieuw leveringssysteem te ontwerpen als een bedrijf een nieuw medicijn maakt, hopen we dat ze in plaats daarvan modulaire, herconfigureerbare platforms zoals de onze kunnen gebruiken, waardoor de snelheid waarmee gen- en celtherapieën worden ontwikkeld en geëvalueerd wordt versneld.”
De beloften en uitdagingen van gerichte medicijnafgifte
Door defecte genen te vervangen of gezonde nieuwe genen of cellen aan een patiënt toe te dienen, zijn gen- en celtherapieën veelbelovend voor de behandeling van een breed scala aan ziekten. Met behulp van een toedieningsvoertuig komen gentherapieën het lichaam binnen om genetisch materiaal naar specifieke cellen over te brengen om ziekten te behandelen of te voorkomen. Celtherapieën gebruiken een vergelijkbare aanpak, maar dragen volledige cellen over, die doorgaans buiten het lichaam worden aangepast voordat ze worden toegediend.
In de meest succesvolle gevallen hebben virale vectoren – die delen gebruiken die zijn afgeleid van virussen maar geen infectie kunnen veroorzaken – gediend als toedieningsmechanisme voor zowel cel- als gentherapieën. Maar deze strategie brengt beperkingen met zich mee. Het immuunsysteem herkent virusdelen soms als lichaamsvreemd en blokkeert dergelijke vectoren voordat ze hun lading afleveren.
“Virussen hebben een natuurlijk vermogen om cellen binnen te dringen en vracht af te leveren”, zei Leonard. “Het lenen van virale onderdelen is een effectieve strategie om verspreiding te bewerkstelligen, maar dan ben je enigszins beperkt tot de soorten verspreiding waarvoor het virus is geëvolueerd. Er is aanzienlijk technisch werk nodig om die systemen aan te passen om hun functies voor elke toepassing te wijzigen. In dit verhaal In plaats daarvan hebben we geprobeerd de strategie na te bootsen die virussen hebben ontwikkeld, maar we hebben nieuwe biologische ‘onderdelen’ gebruikt om enkele beperkingen van virale vectoren te overwinnen en uiteindelijk nieuwe functionaliteiten mogelijk te maken.”
Om een multifunctioneel voertuig te ontwerpen, keken de onderzoekers naar elektrische voertuigen, die Leonard omschreef als ‘een schone lei’. In alle levende wezens (van gist tot planten tot mensen) scheiden cellen op natuurlijke wijze EV’s af, waarvan onderzoekers denken dat ze een belangrijke rol spelen in de communicatie tussen cellen en natuurlijke processen zoals de immuunfunctie.
“Deze deeltjes worden voortdurend uitgestoten en opgenomen door cellen, zowel bij gezonde als bij ziekteprocessen,” zei Leonard. “We weten bijvoorbeeld dat kankercellen EV’s afgeven, en dat lijkt deel uit te maken van het proces waarbij kanker zich van de ene plaats naar de andere verspreidt. Aan de andere kant brengen EV’s ook monsters van binnendringende ziekteverwekkers over van geïnfecteerde cellen naar immuuncellen. , waardoor het lichaam een effectief antwoord kan formuleren.”
Een ‘schone lei’ benutten
Voor Leonards EV-gebaseerde platform ontwikkelde en synthetiseerde zijn team aangepaste DNA-moleculen die in een productiecel werden geïntroduceerd. Het DNA gaf instructies aan de productiecel om nieuwe biomoleculen te produceren en die moleculen vervolgens op het oppervlak en in de binnenkant van EV’s te laden. Dit leverde effectief EV’s op die waren versierd met specifiek ontworpen kenmerken – en lading die al op sleeptouw was.
“We behandelen de EV’s die door cellen worden geproduceerd als in wezen schone leien waarop we nieuwe functies kunnen samenstellen door die productiecellen te manipuleren om gemanipuleerde of natuurlijke eiwitten en nucleïnezuren tot expressie te brengen,” zei Leonard. “Deze veranderen de EV-functie en kunnen een bioactieve, therapeutische lading omvatten.”
Om succesvol te zijn, moeten de EV’s zich op de juiste cellen richten, hun lading naar die cellen overbrengen en bijwerkingen vermijden – en dat alles terwijl ze het altijd waakzame immuunsysteem van de patiënt vermijden. Vergeleken met virussen zijn EV’s waarschijnlijk beter in staat om afstoting door het immuunsysteem te omzeilen. Omdat EV’s kunnen worden geproduceerd met materialen die grotendeels in de eigen cellen van de patiënt voorkomen, is de kans kleiner dat het lichaam de deeltjes als een vreemde substantie behandelt.
De T-cel-uitdaging
Om het concept te testen, keken Leonard en zijn team naar een aantrekkelijk maar koppig doelwit: T-cellen. Omdat T-cellen het lichaam op natuurlijke wijze helpen bij het bestrijden van ziektekiemen en ziekten, hebben onderzoekers geprobeerd de natuurlijke capaciteiten van T-cellen voor immunotherapietoepassingen te verbeteren.
“De meeste cellen nemen voortdurend monsters van kleine stukjes van hun omgeving”, zegt hoofdauteur van het onderzoek, Devin Stranford, afgestudeerd aan Leonard’s laboratorium en nu wetenschapper bij Syenex. “Maar om welke reden dan ook doen T-cellen dat niet zo vaak. Daarom is het een uitdaging om medicijnen aan T-cellen af te leveren, omdat ze ze niet actief zullen opnemen. Je moet de biologie op orde hebben om die leveringsgebeurtenissen te kunnen uitvoeren.” te gebeuren.”
In de experimenten hebben de onderzoekers een productiecel ontworpen om EV’s te genereren die zijn geladen met Cas9, een eiwit dat deel uitmaakt van het CRISPR-systeem, gecombineerd met een ontwikkeld RNA-molecuul om het een specifieke DNA-sequentie in het genoom van een cel te laten herkennen en veranderen. De onderzoekers introduceerden de gemodificeerde EV’s in een kweek van T-cellen. De EV’s bonden zich efficiënt aan de T-cellen en leverden met succes hun lading af, wat leidde tot een genetische manipulatie die het gen inactiveerde dat codeert voor een receptor die door HIV wordt gebruikt om T-cellen te infecteren. Hoewel de behandeling van HIV-infecties geen onmiddellijk doel van dit project was, illustreert dit werk niettemin die belofte en demonstreert het soort nieuwe therapeutische functies die de technologie mogelijk maakt.
“Een belangrijk doel van dit werk was het gebruik van rigoureuze methoden om ervoor te zorgen dat de lading helemaal op de plek terechtkwam waar ze heen moest”, zei Leonard. “Omdat we wijzigingen aanbrengen in het genoom van deze cellen, kunnen we krachtige technologieën zoals sequencing van de volgende generatie gebruiken om te bevestigen dat die exacte bewerkingen aanwezig waren in de ontvangende cellen, op de locatie van het genoom waar ze bedoeld waren.”
Wat is het volgende?
Het nieuwe platform, genaamd GEMINI (Genetic Encoded Multifunctional Integrated Nanovesicles), vertegenwoordigt een reeks technologieën voor het genetisch manipuleren van cellen om multifunctionele EV’s te produceren om aan de uiteenlopende behoeften van patiënten te voldoen.
“Afhankelijk van de behandeling heb je misschien wel een miljard EV’s nodig”, zei hij. ‘Maar omdat ze zo klein zijn, gaat het eigenlijk om een kleine hoeveelheid materiaal. Anderen hebben al aangetoond dat EV’s op klinisch vertaalbare manieren op commerciële schaal kunnen worden geproduceerd. Een bijzonder voordeel van het biologisch coderen van EV-functies, zoals wij hebben gedaan, is dat alle complexiteit gaat gepaard met het ontwikkelen van de DNA-programma’s. Als dat eenmaal is gebeurd, zijn dergelijke processen gemakkelijk compatibel met volwassen, bestaande productiemethoden.’
Via Syenex hoopt Leonard het GEMINI-platform, naast andere synthetische biologietechnologieën, te gebruiken om snel de beste leveringsvoertuigen te genereren waarmee ontwikkelaars – variërend van academische spin-outs tot volwassen biotechnologiebedrijven – nieuwe, levensveranderende cellen en genen kunnen ontwerpen. therapieën.
“Door het vermogen aan te tonen om lading- en oppervlaktesamenstellingen van nanoblaasjes genetisch te coderen met het GEMINI-platform, kunnen we een moeilijk biologieprobleem omzetten in een eenvoudiger DNA-engineeringprobleem”, zei Leonard. “Dat stelt ons in staat gebruik te maken van de voortdurende exponentiële verbeteringen in de DNA-synthese en sequencing die de groei van de synthetische biologie hebben gestimuleerd. We zijn optimistisch dat deze benaderingen onderzoekers in staat zullen stellen de grote uitdagingen op het gebied van de levering op te lossen en nieuwe en verbeterde behandelingen te ontwikkelen die een breed publiek ten goede komen. scala aan patiënten.”
Meer informatie:
Devin M. Stranford et al., Genetisch coderen van meerdere functionaliteiten in extracellulaire blaasjes voor de gerichte afgifte van biologische stoffen aan T-cellen, Natuur Biomedische Technologie (2023). DOI: 10.1038/s41551-023-01142-x. www.nature.com/articles/s41551-023-01142-x
Tijdschriftinformatie:
Natuur Biomedische Technologie
Geleverd door Northwestern University